Điều chế oxi trong phòng thí nghiệm là một trong những thí nghiệm cơ bản và quan trọng trong hóa học. Bài viết này sẽ hướng dẫn bạn viết 2 phương trình hóa học (PTHH) phổ biến để điều chế oxi, đồng thời cung cấp thông tin chi tiết về các hóa chất, quy trình thực hiện và những lưu ý an toàn cần thiết. Chúng ta sẽ cùng nhau khám phá cách tạo ra nguồn oxi tinh khiết ngay trong phòng thí nghiệm!
Phương Trình Điều Chế Oxi từ Kali Clorat (KClO3)
Một trong những cách phổ biến nhất để điều chế oxi trong phòng thí nghiệm là sử dụng Kali Clorat (KClO3). Khi nung nóng KClO3 với chất xúc tác Mangan Dioxit (MnO2), phản ứng phân hủy sẽ xảy ra, tạo thành Kali Clorua (KCl) và khí oxi (O2). Phương trình hóa học được viết như sau:
2KClO3 (rắn) --(MnO2, nhiệt độ)--> 2KCl (rắn) + 3O2 (khí)Trong phản ứng này, KClO3 bị phân hủy thành KCl và O2. MnO2 đóng vai trò là chất xúc tác, giúp phản ứng diễn ra nhanh hơn ở nhiệt độ thấp hơn mà không bị tiêu thụ trong quá trình phản ứng.
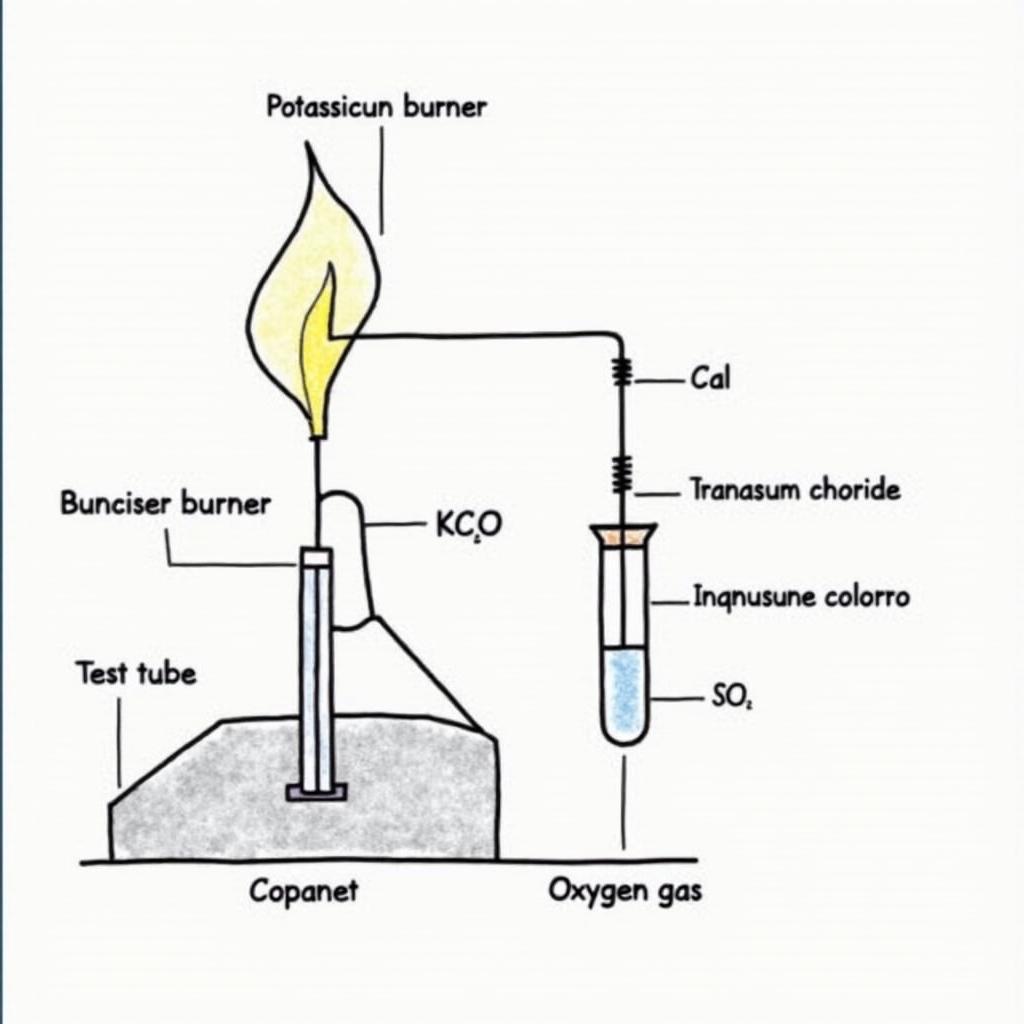 Phân hủy KClO3 để điều chế Oxi
Phân hủy KClO3 để điều chế Oxi
Phương Trình Điều Chế Oxi từ Kali Pemanganat (KMnO4)
Một phương pháp khác để điều chế oxi trong phòng thí nghiệm là nhiệt phân Kali Pemanganat (KMnO4). Khi nung nóng KMnO4 ở nhiệt độ cao, nó sẽ phân hủy thành Kali Manganat (K2MnO4), Mangan Dioxit (MnO2) và khí oxi (O2). Phương trình hóa học của phản ứng này là:
2KMnO4 (rắn) --(nhiệt độ)--> K2MnO4 (rắn) + MnO2 (rắn) + O2 (khí)Phản ứng này cũng tạo ra khí oxi, tuy nhiên, sản phẩm phụ là K2MnO4 và MnO2.
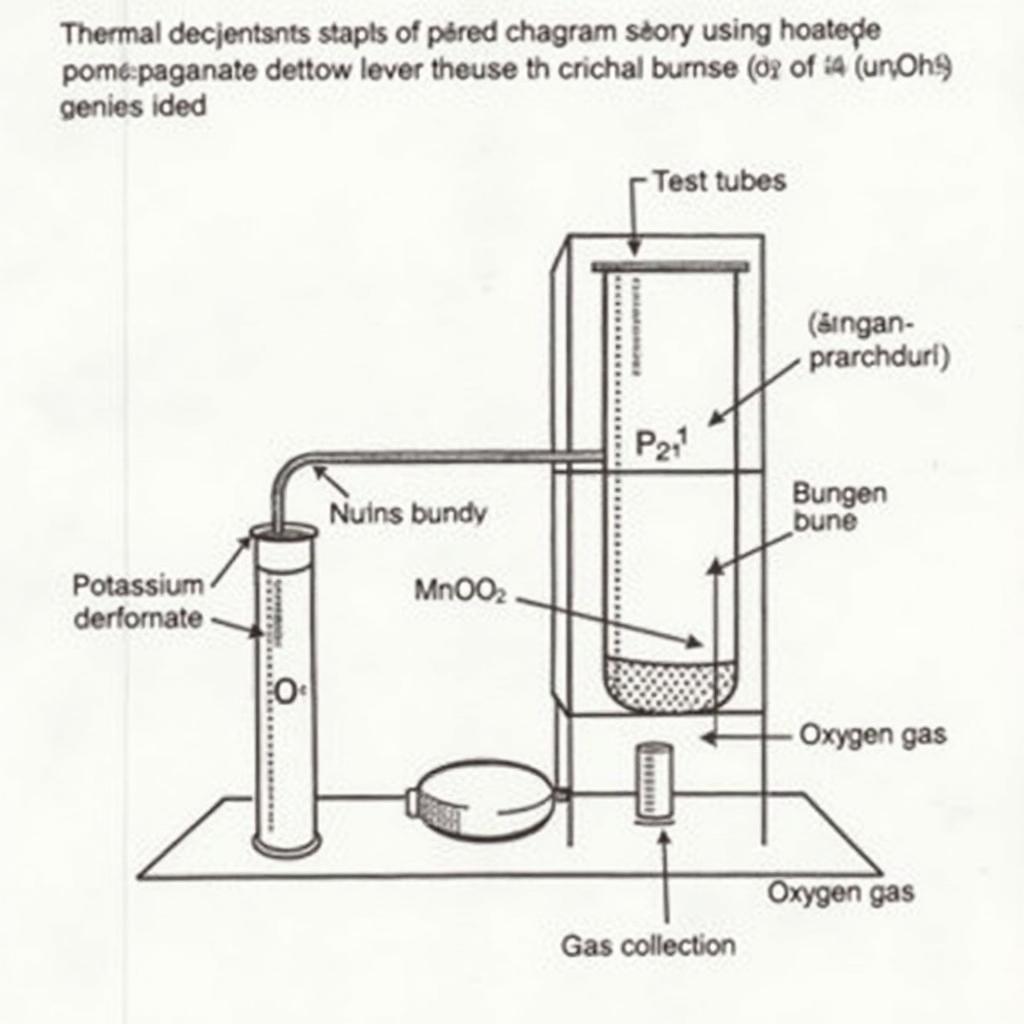 Nhiệt phân KMnO4 để điều chế Oxi
Nhiệt phân KMnO4 để điều chế Oxi
So sánh Hai Phương Pháp Điều Chế Oxi
Cả hai phương pháp đều có thể được sử dụng để điều chế oxi trong phòng thí nghiệm. Tuy nhiên, phương pháp sử dụng KClO3 thường được ưa chuộng hơn vì phản ứng diễn ra êm dịu và dễ kiểm soát hơn. Phương pháp sử dụng KMnO4 có thể tạo ra phản ứng mạnh hơn và khó kiểm soát nếu không thực hiện đúng quy trình.
“Việc lựa chọn phương pháp điều chế oxi phụ thuộc vào mục đích sử dụng và điều kiện thực hiện thí nghiệm. Đối với các thí nghiệm đơn giản, KClO3 là lựa chọn an toàn và hiệu quả.” – PGS. TS. Nguyễn Văn A, chuyên gia Hóa học Vô cơ.
Kết luận
Bài viết này đã trình bày chi tiết Viết 2 Pthh điều Chế Oxi Trong Phòng Thí Nghiệm, bao gồm phương pháp sử dụng KClO3 và KMnO4. Hy vọng bài viết đã cung cấp cho bạn những kiến thức hữu ích về việc điều chế oxi.
FAQ
- Tại sao cần sử dụng chất xúc tác MnO2 trong phản ứng phân hủy KClO3?
- Làm thế nào để thu khí oxi được tạo ra trong phòng thí nghiệm?
- Những lưu ý an toàn khi thực hiện thí nghiệm điều chế oxi là gì?
- KMnO4 có những ứng dụng nào khác ngoài điều chế oxi?
- So sánh hiệu suất của hai phương pháp điều chế oxi.
- Có thể thay thế MnO2 bằng chất xúc tác khác trong phản ứng phân hủy KClO3 không?
- K2MnO4 và MnO2 có độc hại không?
Bạn có thể tìm hiểu thêm về các chủ đề liên quan đến hóa học khác trên website của chúng tôi.
Khi cần hỗ trợ hãy liên hệ Email: [email protected], địa chỉ: Đường Nguyễn Văn Linh, Quận Hải Châu, Đà Nẵng, Việt Nam. Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.
