Axit sunfuric (H2SO4) đặc là một chất hút ẩm mạnh mẽ, thường được sử dụng trong phòng thí nghiệm và công nghiệp để làm khô nhiều loại khí. Vậy H2so4 đặc Có Thể Làm Khô Những Khí Nào? Bài viết này sẽ giải đáp chi tiết câu hỏi này, đồng thời phân tích tính chất của H2SO4 và những lưu ý quan trọng khi sử dụng.
Tính Chất Hút Ẩm Của H2SO4 Đặc
H2SO4 đặc có tính háo nước mạnh, nghĩa là nó có khả năng hấp thụ nước rất hiệu quả từ môi trường xung quanh. Cơ chế hút ẩm của H2SO4 đặc liên quan đến sự hình thành các liên kết hydro với các phân tử nước. Quá trình này tỏa nhiệt, do đó khi hòa tan H2SO4 đặc vào nước, dung dịch sẽ nóng lên đáng kể. Chính nhờ tính chất này mà H2SO4 đặc được sử dụng rộng rãi như một chất làm khô khí.
H2SO4 Đặc Làm Khô Những Khí Nào?
H2SO4 đặc có thể làm khô được nhiều loại khí, bao gồm cả khí hữu cơ và vô cơ, miễn là các khí đó không phản ứng với H2SO4. Một số ví dụ điển hình là:
- Khí oxy (O2): H2SO4 đặc không phản ứng với O2, do đó có thể dùng để làm khô khí này.
- Khí hydro (H2): Tương tự như O2, H2 cũng không phản ứng với H2SO4 đặc, nên có thể được làm khô bằng H2SO4.
- Khí nitơ (N2): N2 là một khí trơ, không phản ứng với H2SO4 đặc, do đó cũng có thể được làm khô.
- Khí clo (Cl2): Cl2 không phản ứng với H2SO4 đặc ở điều kiện thường, nên H2SO4 đặc có thể được sử dụng để loại bỏ hơi nước khỏi Cl2.
- Khí sulfur dioxide (SO2): SO2 tan tốt trong H2SO4 đặc tạo thành oleum, tuy nhiên ở nồng độ thấp có thể xem như không phản ứng.
- Một số khí hữu cơ như ankan, anken, ankin, benzen, v.v… miễn là chúng không chứa các nhóm chức phản ứng với H2SO4.
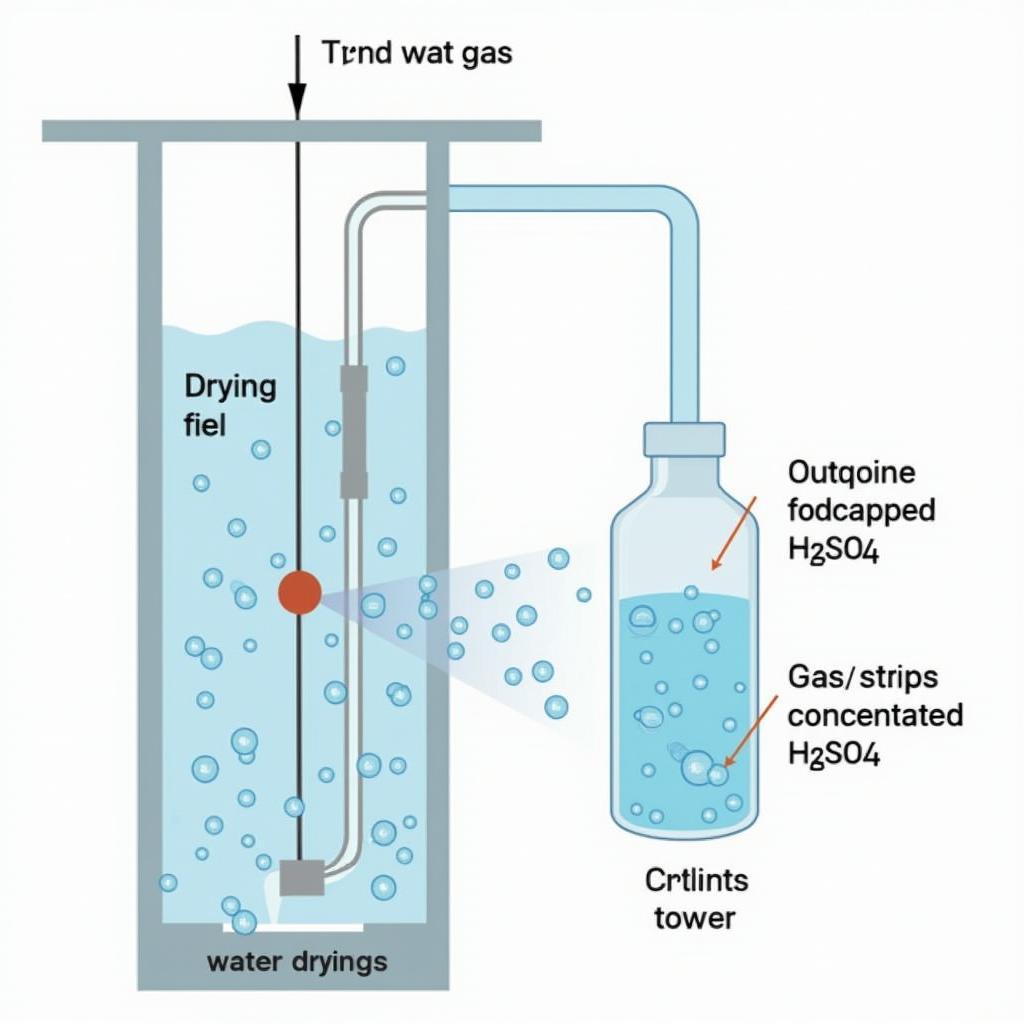 Khí được làm khô bởi H2SO4 đặc
Khí được làm khô bởi H2SO4 đặc
Những Khí Không Thể Làm Khô Bằng H2SO4 Đặc
Tuy nhiên, H2SO4 đặc không thể làm khô những khí có tính tính chất ãit bazơ hoặc có khả năng phản ứng với nó. Dưới đây là một số ví dụ:
- Khí amoniac (NH3): NH3 là một bazơ và sẽ phản ứng với H2SO4 tạo thành sunfat amon.
- Khí hydro sunfua (H2S): H2S là một chất khử và có thể bị H2SO4 đặc oxi hóa thành S ra H2S.
- Khí hydro bromua (HBr) và hydro iotua (HI): HBr và HI là những chất khử mạnh và sẽ bị H2SO4 đặc oxi hóa thành Br2 và I2 tương ứng.
- Các khí có chứa liên kết đôi C=C dễ dàng tham gia phản ứng cộng với H2SO4.
Việc hiểu rõ cách cân bằng phương trình oxi hóa khử rất quan trọng để dự đoán phản ứng giữa H2SO4 đặc và các khí khác.
Lưu Ý Khi Sử Dụng H2SO4 Đặc Để Làm Khô Khí
Khi sử dụng H2SO4 đặc để làm khô khí, cần lưu ý một số điểm sau:
- Luôn luôn sử dụng H2SO4 đặc trong điều kiện an toàn, tránh tiếp xúc trực tiếp với da và mắt.
- Cần chắc chắn rằng khí cần làm khô không phản ứng với H2SO4.
- Sau khi sử dụng, cần xử lý H2SO4 đã qua sử dụng đúng cách để tránh gây ô nhiễm môi trường.
Kết Luận
H2SO4 đặc là một chất làm khô khí hiệu quả cho nhiều loại khí, nhưng không phải tất cả. Việc hiểu rõ tính chất của H2SO4 và các khí cần làm khô là rất quan trọng để đảm bảo an toàn và hiệu quả trong quá trình sử dụng. Bằng cách nắm vững những thông tin trên, bạn có thể sử dụng H2SO4 đặc một cách an toàn và hiệu quả để làm khô những khí phù hợp.
FAQ
- Tại sao H2SO4 đặc có tính hút ẩm mạnh?
- H2SO4 đặc có thể làm khô khí CO2 không?
- Làm thế nào để xử lý H2SO4 đã qua sử dụng?
- Có thể thay thế H2SO4 đặc bằng chất làm khô nào khác?
- H2SO4 đặc có thể làm khô khí nào trong dãy ankan?
- Sự khác biệt giữa H2SO4 đặc và loãng là gì?
- Tại sao không thể dùng H2SO4 đặc để làm khô NH3?
Mô tả các tình huống thường gặp câu hỏi.
Thường gặp câu hỏi về việc H2SO4 có thể làm khô khí nào trong các bài tập hóa học, đặc biệt là trong chương trình hóa học phổ thông. Việc nắm rõ kiến thức này giúp học sinh tránh nhầm lẫn và áp dụng đúng trong các bài toán thực tế.
Gợi ý các câu hỏi khác, bài viết khác có trong web.
Bạn có thể tìm hiểu thêm về nahs naoh trên trang web của chúng tôi.
