Công Thức Tính Thể Tích Chất Khí là một công cụ quan trọng trong hóa học, giúp chúng ta hiểu và dự đoán hành vi của các chất khí trong các điều kiện khác nhau. Bài viết này sẽ đi sâu vào chi tiết về các công thức, ứng dụng và các yếu tố ảnh hưởng đến thể tích chất khí.
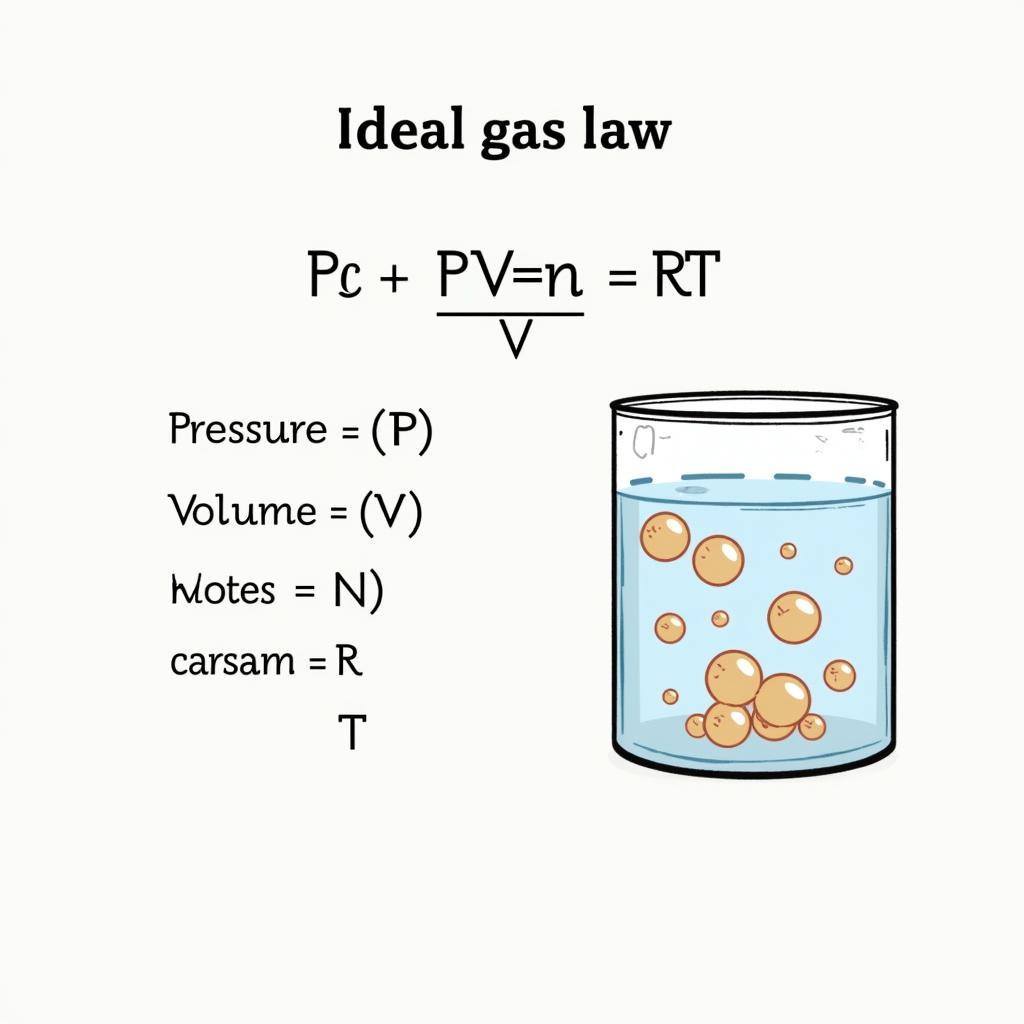 Công thức tính thể tích khí lý tưởng
Công thức tính thể tích khí lý tưởng
Định Luật Khí Lý Tưởng và Công Thức Tính Thể Tích
Định luật khí lý tưởng là nền tảng cho công thức tính thể tích chất khí. Công thức này, PV=nRT, mô tả mối quan hệ giữa áp suất (P), thể tích (V), số mol (n), hằng số khí lý tưởng (R), và nhiệt độ tuyệt đối (T) của một khí lý tưởng. Từ công thức này, ta có thể rút ra công thức tính thể tích chất khí: V = nRT/P. Điều này có nghĩa là thể tích của một khí lý tưởng tỉ lệ thuận với số mol và nhiệt độ, và tỉ lệ nghịch với áp suất. các công thức tính thể tích trong hóa học
“Việc hiểu rõ định luật khí lý tưởng và công thức tính thể tích chất khí là bước đầu tiên để nắm vững hóa học khí,” – TS. Nguyễn Hoàng Anh, chuyên gia hóa lý tại Đại học Quốc gia Hà Nội.
Áp Dụng Công Thức Tính Thể Tích Chất Khí trong Thực Tế
Công thức tính thể tích chất khí có rất nhiều ứng dụng trong thực tế, từ việc tính toán lượng khí cần thiết cho phản ứng hóa học trong công nghiệp đến việc dự đoán sự thay đổi thể tích của lốp xe khi nhiệt độ thay đổi. Ví dụ, trong công nghiệp sản xuất amoniac, việc tính toán thể tích khí nitơ và hydro cần thiết là rất quan trọng để tối ưu hóa hiệu suất phản ứng.
Các Yếu Tố Ảnh Hưởng Đến Thể Tích Chất Khí
Nhiều yếu tố có thể ảnh hưởng đến thể tích của một chất khí, bao gồm áp suất, nhiệt độ, và số mol. Sự thay đổi bất kỳ yếu tố nào trong số này đều có thể dẫn đến sự thay đổi thể tích của khí. Ví dụ, khi nhiệt độ tăng, thể tích của khí cũng tăng, giả sử áp suất và số mol không đổi.
Áp suất và Thể tích: Mối Quan Hệ Ngược chiều
Áp suất và thể tích có mối quan hệ nghịch đảo. Khi áp suất tăng, thể tích giảm và ngược lại.
Nhiệt độ và Thể tích: Mối Quan Hệ Đồng biến
Nhiệt độ và thể tích có mối quan hệ đồng biến. Khi nhiệt độ tăng, thể tích tăng và ngược lại.
Số Mol và Thể Tích: Tỉ Lệ Thuận
Số mol và thể tích có mối quan hệ tỉ lệ thuận. Khi số mol tăng, thể tích tăng và ngược lại.
“Việc nắm vững các yếu tố ảnh hưởng đến thể tích chất khí là chìa khóa để hiểu và áp dụng công thức tính thể tích một cách hiệu quả,” – PGS. TS. Trần Thị Thu Hà, giảng viên hóa học tại Đại học Bách Khoa Hà Nội. fe có tác dụng với hcl không
Kết luận
Công thức tính thể tích chất khí, dựa trên định luật khí lý tưởng, là một công cụ thiết yếu trong hóa học. Hiểu rõ công thức này và các yếu tố ảnh hưởng đến thể tích chất khí là rất quan trọng cho cả lý thuyết và ứng dụng thực tiễn. al td hcl
FAQ
- Định luật khí lý tưởng là gì?
- Công thức tính thể tích chất khí là gì?
- Các yếu tố nào ảnh hưởng đến thể tích chất khí?
- Mối quan hệ giữa áp suất và thể tích là gì?
- Mối quan hệ giữa nhiệt độ và thể tích là gì?
- Mối quan hệ giữa số mol và thể tích là gì?
- Ứng dụng của công thức tính thể tích chất khí trong thực tế là gì? hồ tinh bột i2
Mô tả các tình huống thường gặp câu hỏi.
Thường gặp các câu hỏi liên quan đến việc áp dụng công thức trong bài toán hóa học cụ thể, hoặc các câu hỏi về sự sai khác giữa khí lý tưởng và khí thực. bán kính 20mm
Gợi ý các câu hỏi khác, bài viết khác có trong web.
Bạn có thể tìm hiểu thêm về các công thức tính toán khác trong hóa học trên trang web của chúng tôi.
