Nhôm (Al) là một trong những nguyên tố phổ biến nhất trong vỏ trái đất và đóng vai trò quan trọng trong nhiều ứng dụng công nghiệp và đời sống. Việc nắm vững Công Thức Tính Nhanh Al là chìa khóa để giải quyết các bài tập hóa học một cách hiệu quả. Bài viết này sẽ cung cấp cho bạn những công thức tính nhanh Al hữu ích, cùng với các ví dụ minh họa cụ thể, giúp bạn chinh phục mọi bài toán hóa học liên quan đến nhôm.
Công Thức Tính Số Mol Al
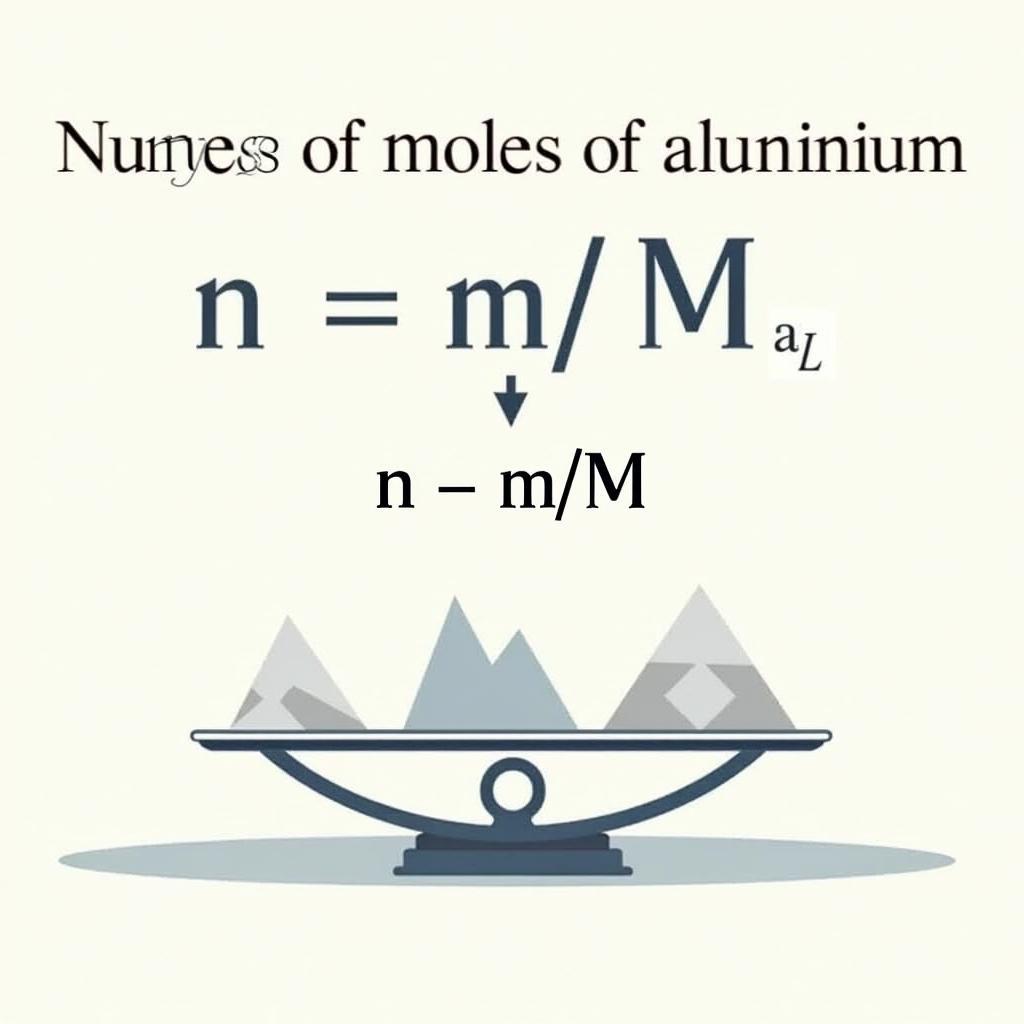
Một trong những công thức cơ bản nhất khi làm bài tập về nhôm là công thức tính số mol. Số mol (n) của Al được tính bằng cách chia khối lượng (m) cho khối lượng mol (M):
n = m / M
Trong đó:
- n là số mol Al (mol)
- m là khối lượng Al (gam)
- M là khối lượng mol của Al (27 g/mol)
Ví dụ: Tính số mol của 54 gam Al.
Áp dụng công thức: n = 54g / 27g/mol = 2 mol
 Tính số mol nhôm
Tính số mol nhôm
Công Thức Tính Khối Lượng Al
Ngược lại với công thức tính số mol, ta có thể tính khối lượng của Al bằng cách nhân số mol với khối lượng mol:
m = n * M
Ví dụ: Tính khối lượng của 0.5 mol Al.
Áp dụng công thức: m = 0.5 mol * 27 g/mol = 13.5 gam
Công Thức Tính Thể Tích Khí Sinh Ra Khi Al Tác Dụng Với Axit
Khi Al phản ứng với axit, thường sinh ra khí hydro (H₂). Công thức tính thể tích khí H₂ sinh ra (ở điều kiện tiêu chuẩn) là:
V = n * 22.4
Trong đó:
- V là thể tích khí H₂ (lít)
- n là số mol H₂ (mol)
Lưu ý: Số mol H₂ cần được xác định dựa trên phương trình phản ứng cụ thể.
Ứng Dụng Của Công Thức Tính Nhanh Al trong Bài Tập
Các công thức tính nhanh Al có ứng dụng rộng rãi trong việc giải quyết các bài tập hóa học, từ việc xác định lượng chất tham gia phản ứng đến tính toán hiệu suất phản ứng. Việc thành thạo các công thức này sẽ giúp bạn tiết kiệm thời gian và nâng cao hiệu quả học tập. Bạn có muốn tìm hiểu thêm về ứng dụng của co2 không?
Ví dụ: Cho 2.7 gam Al tác dụng với dung dịch HCl dư. Tính thể tích khí H₂ sinh ra ở điều kiện tiêu chuẩn.
- Tính số mol Al: n(Al) = 2.7g / 27g/mol = 0.1 mol
- Viết phương trình phản ứng: 2Al + 6HCl → 2AlCl₃ + 3H₂
- Từ phương trình phản ứng, ta thấy 2 mol Al tạo ra 3 mol H₂. Vậy 0.1 mol Al sẽ tạo ra 0.15 mol H₂.
- Tính thể tích khí H₂: V(H₂) = 0.15 mol * 22.4 l/mol = 3.36 lít.
Kết Luận
Nắm vững công thức tính nhanh Al là bước đầu tiên để thành công trong việc học hóa học. Hy vọng bài viết này đã cung cấp cho bạn những kiến thức bổ ích và giúp bạn tự tin hơn khi giải quyết các bài tập liên quan đến nhôm. Hãy cùng khám phá thêm về công thức chung của ankan để mở rộng kiến thức hóa học của bạn nhé!
FAQ
- Khối lượng mol của Al là bao nhiêu? (27 g/mol)
- Công thức tính số mol là gì? (n = m/M)
- Khi Al tác dụng với axit, khí gì được sinh ra? (Khí Hydro – H₂)
- Thể tích của 1 mol khí ở điều kiện tiêu chuẩn là bao nhiêu? (22.4 lít)
- Làm thế nào để tính khối lượng Al từ số mol? (m = n * M)
- Máy HPLC có ứng dụng gì trong phân tích hóa học?
- Etyl axetat là chất gì và ứng dụng của nó trong đời sống?
Hãy xem thêm bài viết về khúc xạ kế đo độ ngọt để tìm hiểu về ứng dụng của thiết bị này.
Khi cần hỗ trợ hãy liên hệ Email: [email protected], địa chỉ: Đường Nguyễn Văn Linh, Quận Hải Châu, Đà Nẵng, Việt Nam. Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.
