Công Thức Hóa Học Lớp 9 là nền tảng quan trọng để học tốt môn Hóa học ở các cấp học cao hơn. Việc nắm vững các công thức này không chỉ giúp bạn giải quyết các bài tập trong sách giáo khoa mà còn giúp bạn hiểu sâu hơn về bản chất của các phản ứng hóa học. Bài viết này sẽ cung cấp cho bạn một cái nhìn tổng quan về các công thức hóa học quan trọng trong chương trình lớp 9, kèm theo những ví dụ minh họa và phương pháp học hiệu quả.
Định Luật Bảo Toàn Khối Lượng và Phương Trình Hóa Học
Trong chương trình hóa học lớp 9, Định luật Bảo toàn Khối Lượng là một trong những khái niệm cơ bản nhất. Định luật này phát biểu rằng trong một phản ứng hóa học, tổng khối lượng của các chất tham gia phản ứng bằng tổng khối lượng của các chất sản phẩm. Từ định luật này, ta có thể lập được phương trình hóa học, một công cụ quan trọng để biểu diễn các phản ứng hóa học. Phương trình hóa học không chỉ cho biết các chất tham gia và sản phẩm mà còn cho biết tỉ lệ số mol giữa chúng.
Ví dụ: Phản ứng giữa kẽm (Zn) và axit clohidric (HCl) tạo ra kẽm clorua (ZnCl2) và khí hidro (H2) được biểu diễn bằng phương trình hóa học sau: Zn + 2HCl → ZnCl2 + H2. Phương trình này cho thấy 1 mol Zn phản ứng với 2 mol HCl tạo ra 1 mol ZnCl2 và 1 mol H2.
Công Thức Tính Số Mol, Khối Lượng và Thể Tích
Ba công thức quan trọng khác mà học sinh lớp 9 cần nắm vững là công thức tính số mol (n), khối lượng (m) và thể tích (V).
- n = m/M (với M là khối lượng mol của chất)
- m = n.M
- V = n.22,4 (đối với chất khí ở điều kiện tiêu chuẩn)
Các công thức này có liên quan mật thiết với nhau và được sử dụng rộng rãi trong việc giải các bài toán hóa học.
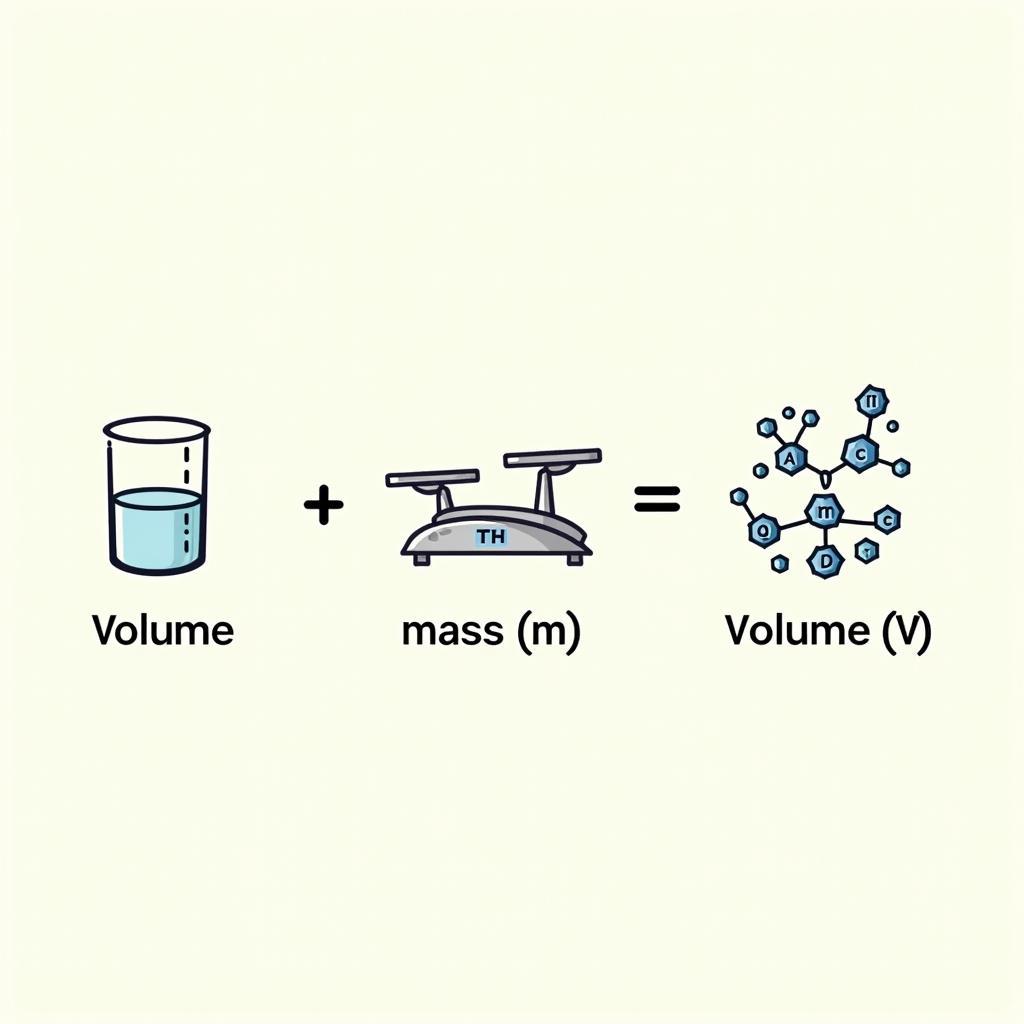 Công thức tính số mol, khối lượng và thể tích
Công thức tính số mol, khối lượng và thể tích
Ví dụ: Tính khối lượng của 2 mol khí oxi (O2). Biết khối lượng mol của O2 là 32 g/mol. Áp dụng công thức m = n.M, ta có m = 2 mol x 32 g/mol = 64g.
Các Loại Phản Ứng Hóa Học
Trong chương trình công thức hóa học lớp 9, học sinh cũng được làm quen với các loại phản ứng hóa học cơ bản như phản ứng hóa hợp, phản ứng phân hủy, phản ứng thế, và phản ứng trao đổi. Việc hiểu rõ đặc điểm của từng loại phản ứng sẽ giúp học sinh dễ dàng nhận biết và viết phương trình hóa học chính xác.
Phản Ứng Hóa Hợp
Phản ứng hóa hợp là phản ứng trong đó hai hay nhiều chất tham gia phản ứng tạo thành một sản phẩm duy nhất.
Ví dụ: 2H2 + O2 → 2H2O (hidro hóa trị mấy).
Phản Ứng Phân Hủy
Phản ứng phân hủy là phản ứng trong đó một chất bị phân hủy thành hai hay nhiều chất khác nhau.
Ví dụ: 2KClO3 → 2KCl + 3O2.
“Hiểu rõ bản chất của từng loại phản ứng là chìa khóa để học tốt hóa học.” – GS.TS Nguyễn Văn A, chuyên gia hóa học hàng đầu Việt Nam.
Kết luận
Công thức hóa học lớp 9 là nền tảng vững chắc cho việc học tập hóa học ở các cấp học tiếp theo. Nắm vững công thức hóa học lớp 9 không chỉ giúp bạn đạt điểm cao trong các kỳ thi mà còn giúp bạn phát triển tư duy logic và khả năng giải quyết vấn đề.
FAQ
- Định luật bảo toàn khối lượng là gì?
- Làm thế nào để lập phương trình hóa học?
- Công thức tính số mol là gì?
- Thế nào là phản ứng hóa hợp?
- Cho ví dụ về phản ứng phân hủy.
- Kim loại kiềm hóa trị mấy?
- Công là gì vật lý?
Mô tả các tình huống thường gặp câu hỏi
Học sinh thường gặp khó khăn trong việc cân bằng phương trình hóa học và áp dụng công thức tính toán số mol, khối lượng, thể tích.
Gợi ý các câu hỏi khác, bài viết khác có trong web.
Xem thêm bài viết về bản tuần hoàn hóa học.
