Cấu Hình E Của F, hay cấu hình electron của Fluor, là một khái niệm cơ bản trong hóa học, giúp chúng ta hiểu được tính chất và khả năng phản ứng của nguyên tố này. Bài viết này sẽ đi sâu vào phân tích cấu hình electron của Fluor, cũng như ứng dụng của nó trong đời sống và công nghiệp.
Tìm hiểu về cấu hình e của f (Fluor)
Cấu hình electron của một nguyên tố cho biết sự sắp xếp của các electron trong các lớp và phân lớp electron của nguyên tố đó. Đối với Fluor (ký hiệu F), số hiệu nguyên tử là 9, nghĩa là nguyên tử Fluor có 9 electron. Vậy cấu hình e của f được biểu diễn như thế nào? Cấu hình electron đầy đủ của Fluor là 1s² 2s² 2p⁵. Điều này có nghĩa là 2 electron nằm trong lớp thứ nhất (1s²), và 7 electron còn lại nằm trong lớp thứ hai, với 2 electron trong phân lớp s (2s²) và 5 electron trong phân lớp p (2p⁵). Cấu hình electron lớp ngoài cùng của Fluor là 2s² 2p⁵.
Cấu hình electron này quyết định tính chất hóa học đặc trưng của Fluor. Với 7 electron ở lớp ngoài cùng, Fluor có xu hướng nhận thêm 1 electron để đạt được cấu hình electron bền vững của khí hiếm Neon (Ne), với 8 electron ở lớp ngoài cùng. Chính vì vậy, Fluor là một phi kim rất hoạt động, dễ dàng tham gia vào các phản ứng hóa học để nhận electron.
Ứng dụng của Fluor trong đời sống và công nghiệp
Cấu hình e của f đóng vai trò quan trọng trong việc xác định tính chất và ứng dụng của nó. Tính phi kim mạnh của Fluor khiến nó trở thành một nguyên tố quan trọng trong nhiều lĩnh vực.
Fluor trong sản xuất polymer
Fluor được sử dụng để sản xuất các loại polymer đặc biệt, như Teflon (PTFE), có khả năng chịu nhiệt và chống dính cao. Teflon được ứng dụng rộng rãi trong sản xuất đồ dùng nhà bếp, như chảo chống dính.
Fluor trong y học
Một số hợp chất của Fluor được sử dụng trong y học, ví dụ như trong kem đánh răng để ngăn ngừa sâu răng.
 Ứng dụng của Fluor trong y học
Ứng dụng của Fluor trong y học
Fluor trong công nghiệp làm lạnh
Một số hợp chất của Fluor, như freon, từng được sử dụng rộng rãi trong công nghiệp làm lạnh. Tuy nhiên, do tác động tiêu cực đến tầng ozone, việc sử dụng freon đã bị hạn chế.
Cấu hình e của f và phản ứng hóa học
Như đã đề cập, Fluor có xu hướng nhận 1 electron để đạt cấu hình electron bền vững. Do đó, Fluor thường tham gia vào các phản ứng oxi hóa khử, trong đó nó đóng vai trò là chất oxi hóa mạnh. Ví dụ, Fluor có thể phản ứng mạnh mẽ với kim loại cấu hình e của kim loại kiềm để tạo thành muối florua.
Ví dụ về phản ứng của Fluor
Phản ứng giữa Fluor và Hidro là một ví dụ điển hình cho tính chất oxi hóa mạnh của Fluor:
F₂ + H₂ → 2HF
Trong phản ứng này, Fluor nhận electron từ Hidro để tạo thành Hidro florua (HF).
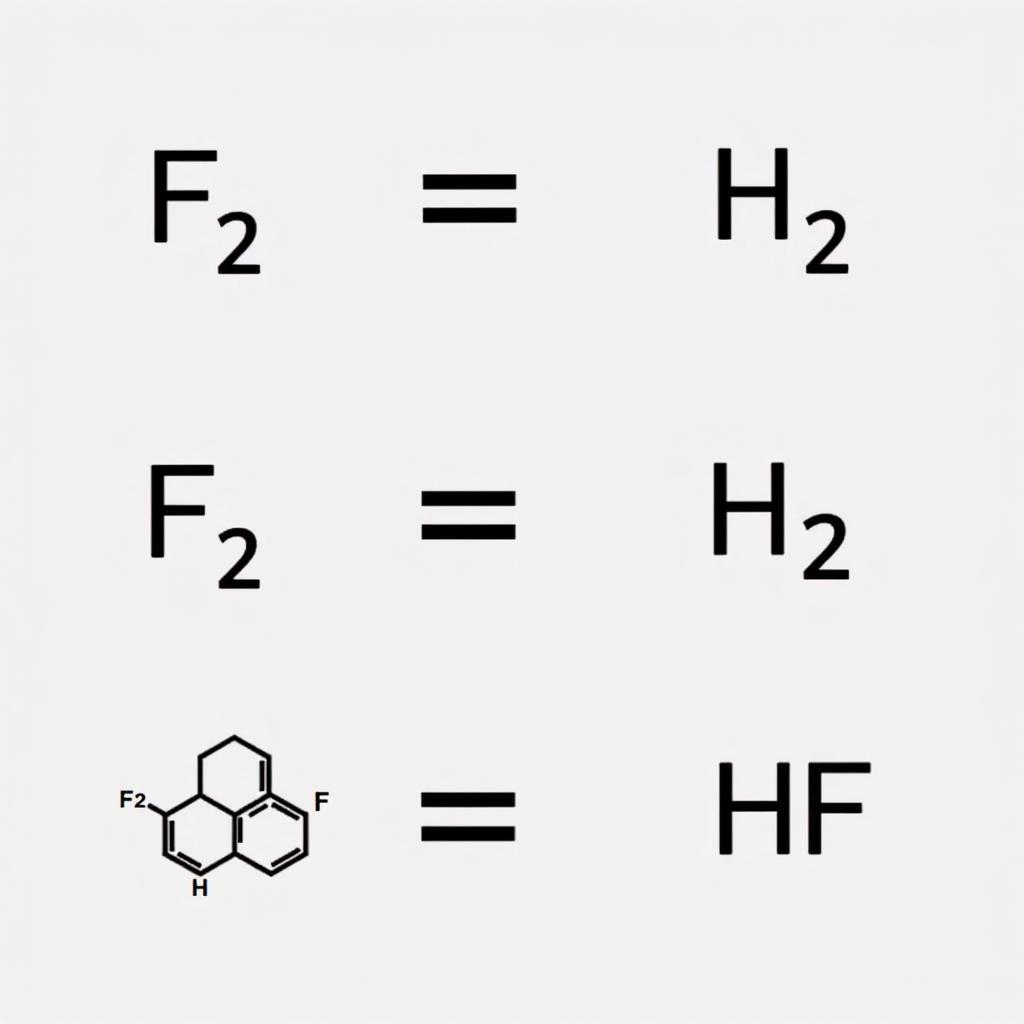 Phản ứng giữa Fluor và Hidro
Phản ứng giữa Fluor và Hidro
Kết luận
Cấu hình e của f (1s² 2s² 2p⁵) quyết định tính chất hóa học của Fluor, khiến nó trở thành một phi kim rất hoạt động và có nhiều ứng dụng quan trọng trong đời sống và công nghiệp. Việc hiểu rõ cấu hình electron nguyên tử là gì giúp ta dự đoán được tính chất và ứng dụng của các nguyên tố hóa học, từ đó ứng dụng vào thực tiễn.
FAQ
- Cấu hình electron của Fluor là gì?
- Tại sao Fluor là một phi kim hoạt động mạnh?
- Ứng dụng của Fluor trong đời sống là gì?
- Fluor có vai trò gì trong công nghiệp?
- Tại sao việc sử dụng freon bị hạn chế?
- Cấu hình e của br là gì?
- Có gì giống và khác nhau giữa cấu tạo của hoa và mô hình h2o2?
Khi cần hỗ trợ hãy liên hệ Email: [email protected], địa chỉ: Đường Nguyễn Văn Linh, Quận Hải Châu, Đà Nẵng, Việt Nam. Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.
