Cấu Hình E Của C, hay cấu hình electron của Carbon, là một khái niệm cơ bản trong hóa học, miêu tả sự sắp xếp của các electron trong nguyên tử Carbon. Việc hiểu rõ cấu hình này giúp ta dự đoán tính chất hóa học và khả năng tạo liên kết của nguyên tố này.
Tìm hiểu về Cấu hình E của C
Cấu hình electron của Carbon (C) là 1s² 2s² 2p². Điều này cho thấy Carbon có 6 electron, với 2 electron ở lớp vỏ trong cùng (1s²) và 4 electron ở lớp vỏ ngoài cùng (2s² 2p²). Chính 4 electron hóa trị này đóng vai trò quan trọng trong việc hình thành liên kết hóa học. Carbon có thể tạo ra nhiều loại liên kết, bao gồm liên kết đơn, đôi và ba, cho phép nó hình thành vô số hợp chất hữu cơ và vô cơ. Nhờ cấu hình e đặc biệt này, Carbon trở thành nền tảng của sự sống trên Trái Đất.
Ý nghĩa của Cấu hình E của C trong Hóa Học
Cấu hình e của C quyết định tính chất hóa học đặc trưng của nguyên tố này. Với 4 electron hóa trị, Carbon có thể tạo liên kết với tối đa 4 nguyên tử khác, tạo thành các hợp chất đa dạng. Ví dụ, trong metan (CH₄), Carbon tạo 4 liên kết đơn với 4 nguyên tử hydro. Trong khi đó, trong etilen (C₂H₄), mỗi nguyên tử Carbon tạo một liên kết đôi với một nguyên tử Carbon khác và hai liên kết đơn với hai nguyên tử hydro. cấu hình e của cr cũng là một ví dụ về nguyên tố có cấu hình electron đặc biệt.
Cấu hình E của C và các hợp chất hữu cơ
Sự đa dạng trong liên kết của Carbon chính là nền tảng cho sự phong phú của các hợp chất hữu cơ. Hàng triệu hợp chất hữu cơ khác nhau được hình thành từ Carbon và các nguyên tố khác như hydro, oxy, nitơ,… Từ các phân tử đơn giản như metan đến các đại phân tử phức tạp như protein và DNA, tất cả đều dựa trên khả năng tạo liên kết linh hoạt của Carbon. Bạn có muốn tìm hiểu về cấu hình e của cr2+ không?
Phân tích sâu hơn về lớp vỏ electron ngoài cùng của C
Sự phân bố electron trong lớp vỏ ngoài cùng 2s² 2p² của Carbon ảnh hưởng trực tiếp đến khả năng phản ứng hóa học của nó. Trong một số trường hợp, một electron từ orbital 2s có thể chuyển sang orbital 2p trống, tạo ra trạng thái kích thích với 4 electron độc thân. Trạng thái này cho phép Carbon tạo 4 liên kết cộng hóa trị, giải thích cho sự hình thành của các hợp chất như CH₄. Việc tìm hiểu cách viết cấu hình electron của ion sẽ giúp bạn hiểu rõ hơn về sự thay đổi cấu hình electron khi nguyên tử trở thành ion.
Cấu hình e của C và các dạng thù hình
Cấu hình e của C cũng ảnh hưởng đến sự hình thành các dạng thù hình khác nhau của Carbon, như kim cương, than chì và fullerene. Sự sắp xếp khác nhau của các nguyên tử Carbon trong các dạng thù hình này dẫn đến sự khác biệt về tính chất vật lý và hóa học. bài tập cấu hình electron nguyên tử sẽ giúp bạn rèn luyện kỹ năng xác định cấu hình electron.
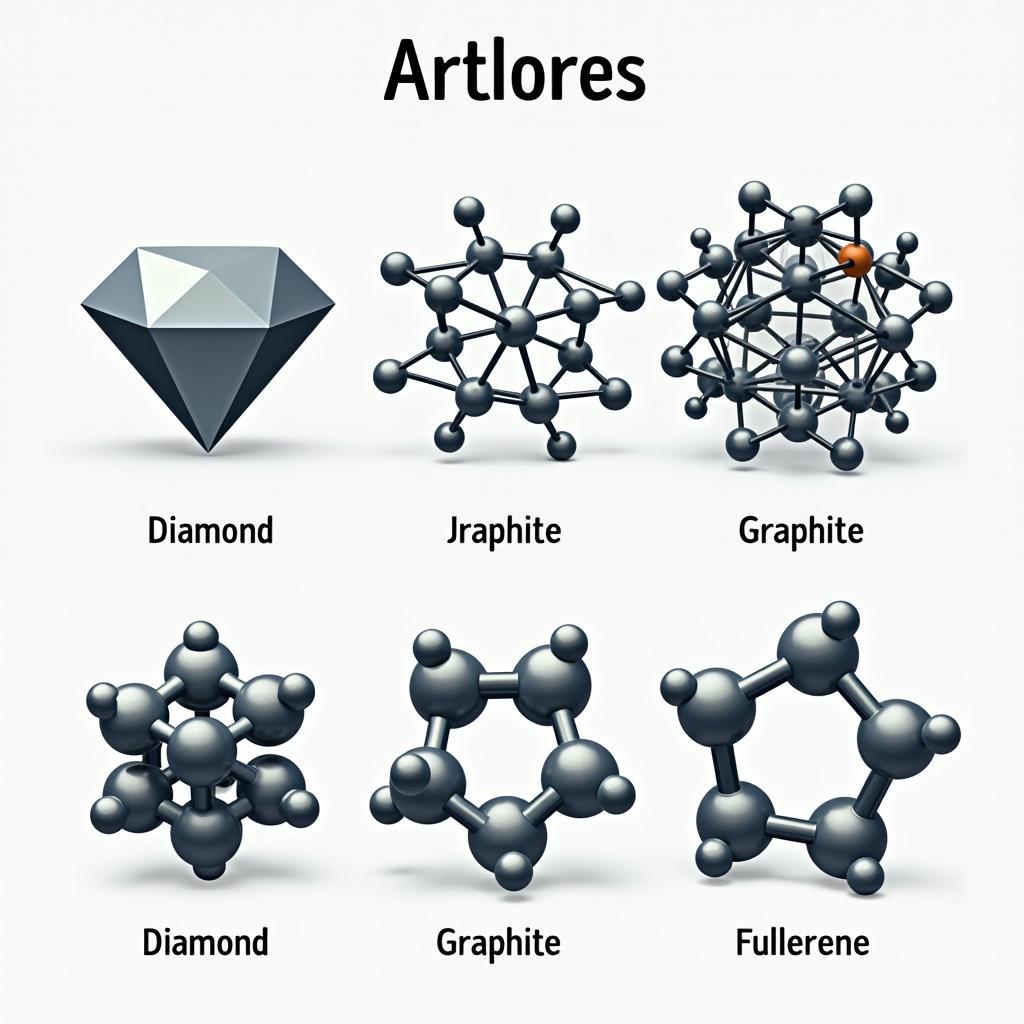 Các dạng thù hình của Carbon
Các dạng thù hình của Carbon
Kết luận: Cấu hình E của C – Chìa khóa của Sự sống
Cấu hình e của C, 1s² 2s² 2p², là yếu tố then chốt quyết định tính chất hóa học và khả năng tạo liên kết đa dạng của Carbon. Chính nhờ cấu hình này mà Carbon trở thành nguyên tố trung tâm trong hóa học hữu cơ và là nền tảng của sự sống. cấu hình e của ne cung cấp một ví dụ khác về cấu hình electron của nguyên tử.
FAQ
- Cấu hình electron của Carbon là gì?
- Tại sao Carbon lại quan trọng trong hóa học hữu cơ?
- Các dạng thù hình của Carbon là gì?
- Cấu hình electron ảnh hưởng như thế nào đến tính chất của Carbon?
- Carbon có thể tạo ra những loại liên kết hóa học nào?
- Electron hóa trị của Carbon là gì?
- Sự khác biệt giữa cấu hình electron của Carbon ở trạng thái cơ bản và trạng thái kích thích là gì?
Mô tả các tình huống thường gặp câu hỏi.
Sinh viên thường gặp khó khăn trong việc xác định cấu hình electron của các nguyên tố, đặc biệt là khi liên quan đến các quy tắc như quy tắc Hund và nguyên lý Aufbau. Họ cũng thường nhầm lẫn giữa cấu hình electron ở trạng thái cơ bản và trạng thái kích thích.
Gợi ý các câu hỏi khác, bài viết khác có trong web.
Bạn có thể tìm hiểu thêm về cấu hình electron của các nguyên tố khác như Crom (Cr) và Neon (Ne) trên trang web của chúng tôi.
