Cấu hình electron của oxi đóng vai trò then chốt trong việc xác định tính chất hóa học đặc trưng của nguyên tố này. Bài viết này sẽ đi sâu vào phân tích Cấu Hình Của Oxi, từ cấu hình electron cơ bản đến các trạng thái oxi hóa phổ biến, và ứng dụng của nó trong đời sống và công nghiệp.
Cấu Hình Electron Cơ Bản của Oxi
Oxi, với số hiệu nguyên tử là 8, có cấu hình electron cơ bản là 1s² 2s² 2p⁴. Điều này có nghĩa là oxi có 8 electron, với 2 electron ở lớp vỏ trong cùng (1s) và 6 electron ở lớp vỏ ngoài cùng (2s và 2p). Cấu hình electron lớp ngoài cùng 2s² 2p⁴ này chính là yếu tố quyết định tính chất hóa học của oxi, đặc biệt là khả năng tạo liên kết hóa học với các nguyên tố khác. 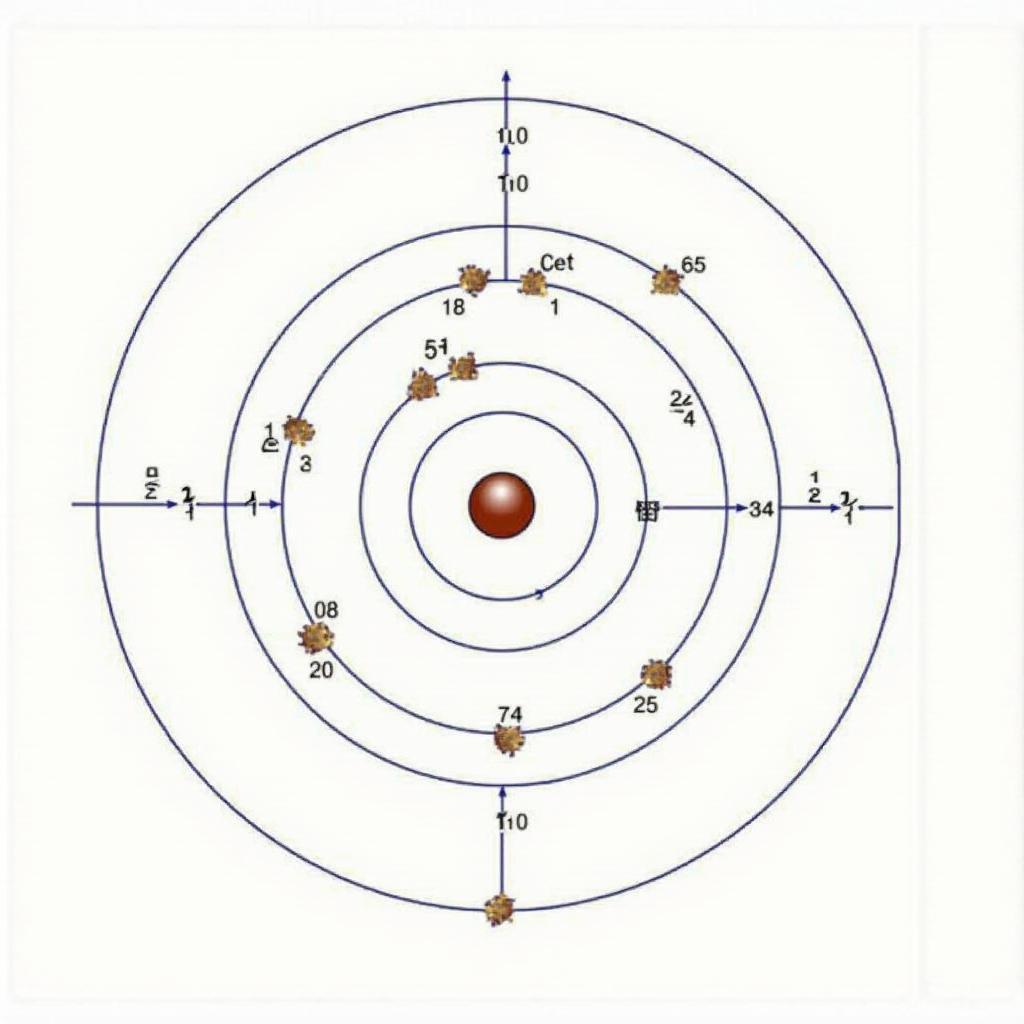 Cấu hình electron của nguyên tử oxi
Cấu hình electron của nguyên tử oxi
Đặc biệt, lớp vỏ ngoài cùng của oxi chỉ thiếu 2 electron để đạt được cấu hình electron bền vững của khí hiếm neon (1s² 2s² 2p⁶). Chính vì vậy, oxi có xu hướng nhận thêm 2 electron để đạt được cấu hình octet, tạo thành ion O²⁻. Sự dễ dàng nhận electron này giải thích tính oxi hóa mạnh mẽ của oxi.
cách cân bằng phương trình oxi hóa khử
Trạng Thái Oxi Hóa của Oxi
Mặc dù trạng thái oxi hóa phổ biến nhất của oxi là -2, oxi cũng có thể tồn tại ở các trạng thái oxi hóa khác như -1 (trong peroxit như H₂O₂), 0 (trong O₂), +1 (trong một số hợp chất với flo) và +2 (trong OF₂). Sự đa dạng về trạng thái oxi hóa này cho thấy oxi có thể tham gia vào nhiều loại phản ứng hóa học khác nhau.
 Các trạng thái oxi hóa của oxi
Các trạng thái oxi hóa của oxi
Ứng Dụng của Oxi Dựa trên Cấu Hình
Cấu hình electron và các trạng thái oxi hóa của oxi quyết định nhiều ứng dụng quan trọng của nó trong đời sống và công nghiệp. Ví dụ, tính oxi hóa mạnh của oxi được ứng dụng trong quá trình đốt cháy nhiên liệu để tạo ra năng lượng. Trong y tế, oxi được sử dụng để hỗ trợ hô hấp cho bệnh nhân. Trong công nghiệp, oxi được sử dụng trong sản xuất thép, hàn cắt kim loại và nhiều quá trình hóa học khác.
Cấu hình Oxi và Liên Kết Hóa Học
Cấu hình electron của oxi cho phép nó tạo thành liên kết hóa học với nhiều nguyên tố khác. Phổ biến nhất là liên kết cộng hóa trị, trong đó oxi chia sẻ electron với các nguyên tố khác để đạt được cấu hình octet. Ví dụ, trong phân tử nước (H₂O), oxi tạo thành hai liên kết cộng hóa trị với hai nguyên tử hydro.
“Hiểu rõ cấu hình electron của oxi là chìa khóa để nắm bắt tính chất và ứng dụng đa dạng của nguyên tố này,” – GS.TS. Nguyễn Văn A, chuyên gia hóa học tại Đại học Khoa học Tự nhiên.
Tại sao Cấu hình Oxi Quan Trọng?
Cấu hình electron của oxi không chỉ giải thích tính chất hóa học của nó mà còn giúp dự đoán khả năng phản ứng của oxi với các chất khác. Việc hiểu rõ cấu hình này là nền tảng cho việc nghiên cứu và ứng dụng oxi trong nhiều lĩnh vực khoa học và công nghệ.
 Ứng dụng của oxi trong đời sống
Ứng dụng của oxi trong đời sống
Kết luận
Cấu hình của oxi, 1s² 2s² 2p⁴, là yếu tố quyết định tính chất hóa học và ứng dụng đa dạng của nguyên tố này. Từ việc tạo ra năng lượng đến hỗ trợ sự sống, oxi đóng vai trò quan trọng không thể thiếu trong thế giới tự nhiên và hoạt động của con người.
FAQ
- Cấu hình electron của oxi là gì?
- Tại sao oxi có tính oxi hóa mạnh?
- Oxi có những trạng thái oxi hóa nào?
- Ứng dụng của oxi trong công nghiệp là gì?
- Cấu hình electron ảnh hưởng như thế nào đến liên kết hóa học của oxi?
- Làm thế nào để xác định cấu hình electron của oxi?
- Tầm quan trọng của việc hiểu cấu hình electron của oxi là gì?
Mô tả các tình huống thường gặp câu hỏi.
Các câu hỏi thường gặp xoay quanh việc xác định cấu hình, so sánh với các nguyên tố khác, và ảnh hưởng của cấu hình đến tính chất hóa học của oxi.
Gợi ý các câu hỏi khác, bài viết khác có trong web.
Xem thêm bài viết về oxit kẽm là gì để tìm hiểu về một hợp chất của oxi.
