Bazơ mạnh là những hợp chất hóa học có khả năng phân ly hoàn toàn trong dung dịch nước, tạo ra nồng độ ion hydroxide (OH-) cao. Chúng đóng vai trò quan trọng trong nhiều lĩnh vực, từ đời sống hàng ngày đến các ngành công nghiệp phức tạp. Bài viết này sẽ cung cấp kiến thức toàn diện về bazơ mạnh, bao gồm tính chất đặc trưng, ứng dụng phổ biến, và những lưu ý quan trọng khi sử dụng.
Tính Chất Đặc Trưng của Bazơ Mạnh
Bazơ mạnh thường là các hydroxide của kim loại kiềm (nhóm IA) và kim loại kiềm thổ (nhóm IIA) như NaOH, KOH, Ca(OH)2, và Ba(OH)2. Chúng có những tính chất đặc trưng sau:
- Độ pH cao: Dung dịch bazơ mạnh luôn có độ pH lớn hơn 7, thường nằm trong khoảng từ 10 đến 14. Độ pH càng cao, tính bazơ càng mạnh.
- Làm đổi màu chất chỉ thị: Bazơ mạnh làm quỳ tím chuyển sang màu xanh, dung dịch phenolphthalein chuyển sang màu hồng.
- Tác dụng với axit: Bazơ mạnh phản ứng mạnh mẽ với axit để tạo thành muối và nước. Phản ứng này được gọi là phản ứng trung hòa.
- Tác dụng với oxit axit: Bazơ mạnh tác dụng với oxit axit tạo thành muối và nước.
- Tác dụng với một số muối: Bazơ mạnh có thể phản ứng với một số muối để tạo thành bazơ mới và muối mới.
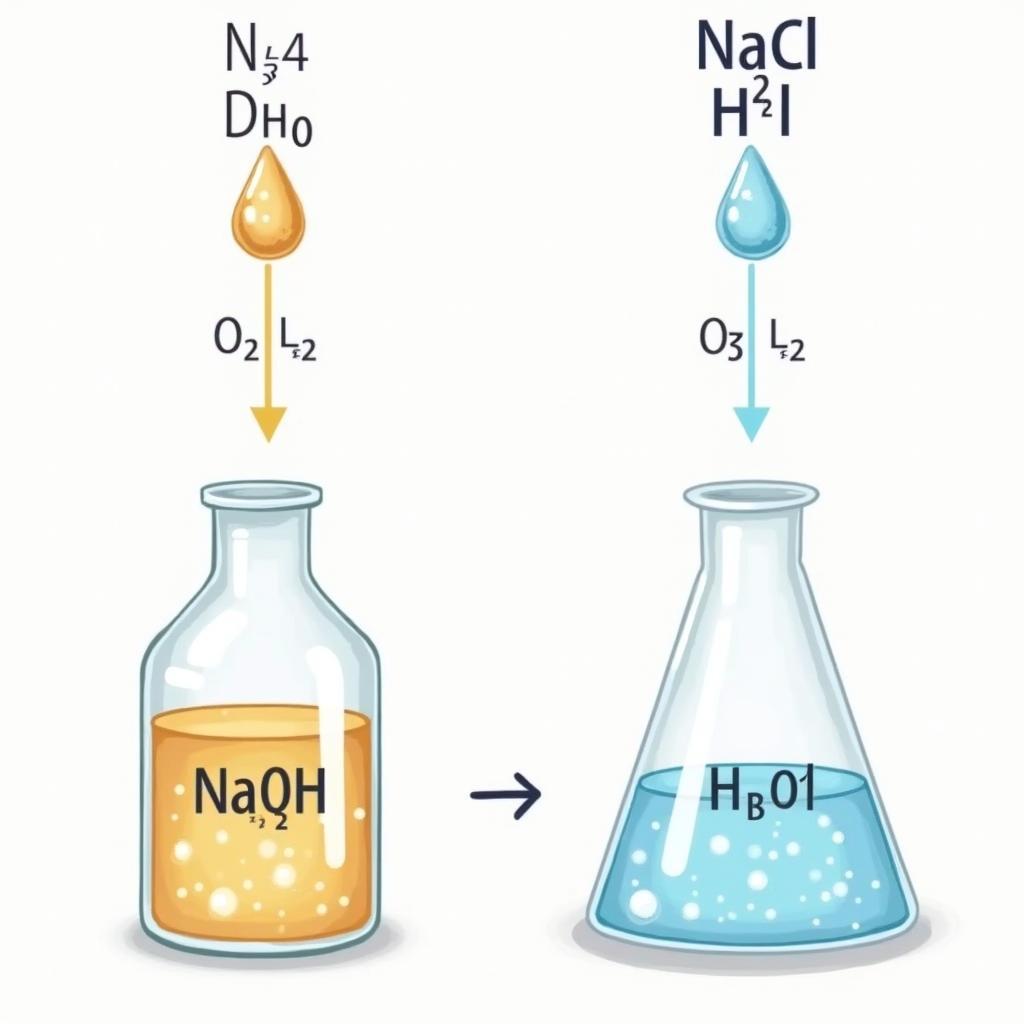 Phản ứng của bazơ mạnh với axit
Phản ứng của bazơ mạnh với axit
Chuyên gia Nguyễn Thị Lan, giảng viên hóa học tại Đại học Khoa học Tự nhiên, cho biết: “Tính bazơ mạnh của các hợp chất này xuất phát từ khả năng phân ly hoàn toàn trong nước, giải phóng một lượng lớn ion OH-, làm tăng đáng kể độ pH của dung dịch.”
Ứng Dụng của Bazơ Mạnh trong Đời Sống và Công Nghiệp
Bazơ mạnh có ứng dụng rộng rãi trong nhiều lĩnh vực khác nhau:
- Sản xuất xà phòng và chất tẩy rửa: NaOH và KOH là những nguyên liệu quan trọng trong sản xuất xà phòng và chất tẩy rửa.
- Công nghiệp giấy và bột giấy: NaOH được sử dụng để xử lý gỗ trong quá trình sản xuất giấy và bột giấy.
- Sản xuất thuốc nhuộm và thuốc trừ sâu: Một số bazơ mạnh được sử dụng trong quá trình tổng hợp thuốc nhuộm và thuốc trừ sâu.
- Xử lý nước thải: Ca(OH)2 được sử dụng để xử lý nước thải, loại bỏ các chất ô nhiễm.
- Trong phòng thí nghiệm: Bazơ mạnh được sử dụng làm chất phản ứng trong nhiều phản ứng hóa học.
Bạn đã biết na2so4 là axit hay bazơ chưa?
Những Điều Cần Lưu Ý Khi Sử dụng Bazơ Mạnh
Bazơ mạnh có tính ăn mòn cao, do đó cần phải cẩn thận khi sử dụng. Dưới đây là một số lưu ý quan trọng:
- Luôn đeo găng tay, kính bảo hộ và khẩu trang khi tiếp xúc với bazơ mạnh.
- Tránh để bazơ mạnh tiếp xúc với da, mắt và đường hô hấp.
- Bảo quản bazơ mạnh ở nơi khô ráo, thoáng mát, tránh ánh nắng trực tiếp.
- Không đổ bazơ mạnh trực tiếp xuống cống rãnh.
TS. Phạm Văn Minh, chuyên gia hóa học tại Viện Hóa Học, nhấn mạnh: “Việc tuân thủ các quy định an toàn khi sử dụng bazơ mạnh là vô cùng quan trọng để tránh những tai nạn đáng tiếc.” Hãy tìm hiểu bazo tan có những tính chất hóa học nào để hiểu rõ hơn về tính chất của bazơ.
Kết luận
Bazơ mạnh là những hợp chất hóa học quan trọng với nhiều ứng dụng thiết thực. Hiểu rõ về tính chất và cách sử dụng an toàn của chúng là điều cần thiết cho cả trong đời sống và công nghiệp. Hy vọng bài viết này đã cung cấp cho bạn những kiến thức hữu ích về bazơ mạnh. Bạn cũng có thể tham khảo thêm về h3po4 là axit mạnh hay yếu để so sánh với tính chất của bazơ mạnh.
FAQ
- Bazơ mạnh là gì?
- Những ví dụ về bazơ mạnh là gì?
- Làm thế nào để nhận biết bazơ mạnh?
- Ứng dụng của bazơ mạnh là gì?
- Những lưu ý khi sử dụng bazơ mạnh là gì?
- Sự khác biệt giữa bazơ mạnh và bazơ yếu là gì?
- Bazơ mạnh có tác dụng với kim loại không?
Mô tả các tình huống thường gặp câu hỏi.
Người dùng thường tìm kiếm thông tin về bazơ mạnh khi họ muốn tìm hiểu về tính chất, ứng dụng, và cách sử dụng an toàn của chúng. Họ cũng có thể muốn so sánh bazơ mạnh với bazơ yếu, hoặc tìm kiếm các ví dụ cụ thể về bazơ mạnh. Một số người dùng có thể quan tâm đến các phản ứng hóa học liên quan đến bazơ mạnh. Có thể bạn quan tâm ch3cooh là axit mạnh hay yếu và nh4cl điện li mạnh hay yếu.
Gợi ý các câu hỏi khác, bài viết khác có trong web.
Bạn có thể tìm hiểu thêm về các chủ đề liên quan như axit, muối, pH, và các phản ứng hóa học khác trên website Friend LENS.
