Chuẩn độ là một kỹ thuật phân tích định lượng quan trọng trong hóa học, được sử dụng rộng rãi để xác định nồng độ của một dung dịch chưa biết. Bài viết này sẽ cung cấp kiến thức toàn diện về Bài Tập Chuẩn độ, từ cơ bản đến nâng cao, giúp bạn nắm vững phương pháp này và áp dụng thành công trong học tập và nghiên cứu.
Chuẩn Độ Là Gì? Khái Niệm Cơ Bản Về Bài Tập Chuẩn Độ
Chuẩn độ, hay còn gọi là phép chuẩn độ, là quá trình thêm từ từ một dung dịch có nồng độ đã biết (dung dịch chuẩn) vào dung dịch có nồng độ cần xác định (dung dịch phân tích) cho đến khi phản ứng giữa hai dung dịch vừa đủ. Điểm này được gọi là điểm tương đương, thường được xác định bằng sự thay đổi màu của chất chỉ thị. 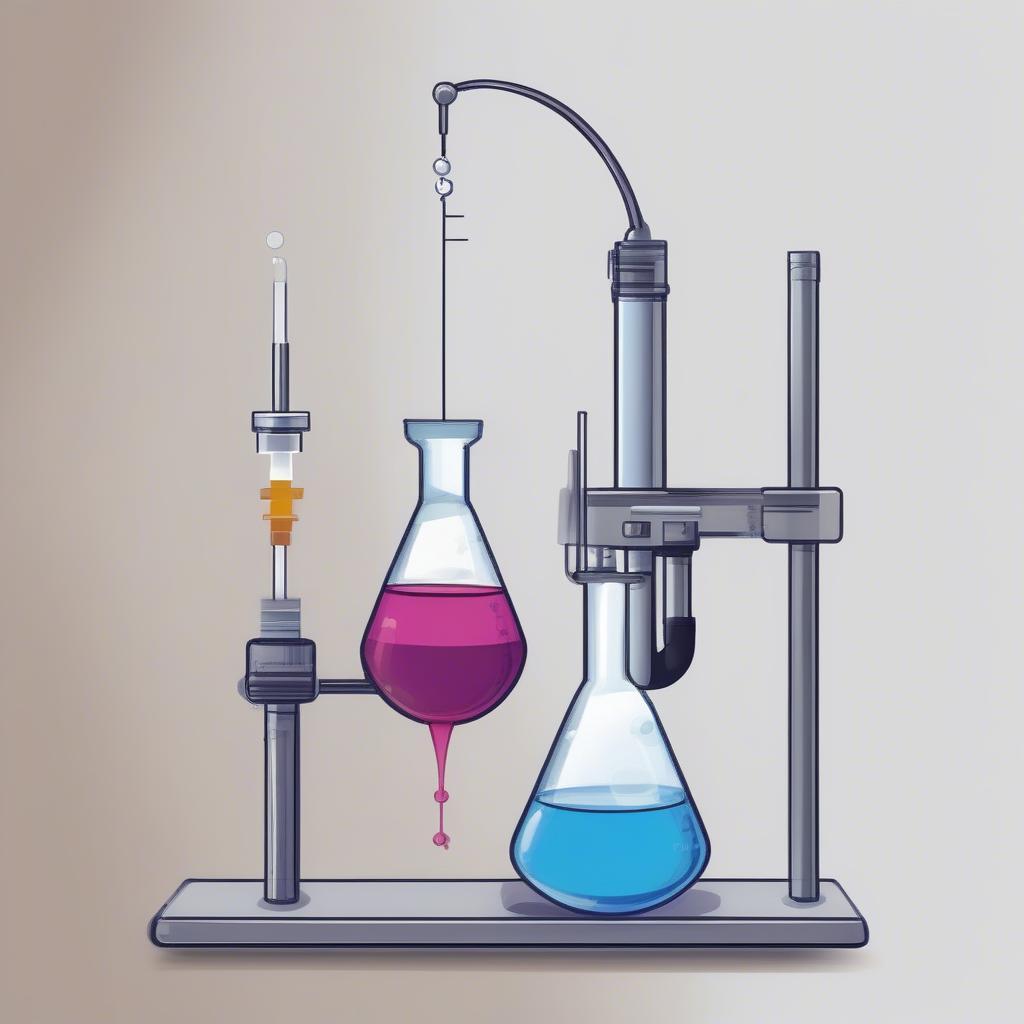 Bài tập chuẩn độ: Khái niệm
Bài tập chuẩn độ: Khái niệm
Việc giải bài tập chuẩn độ đòi hỏi hiểu rõ nguyên tắc phản ứng, tính toán chính xác và sử dụng công thức phù hợp. Thông thường, bài tập chuẩn độ sẽ yêu cầu tính nồng độ của dung dịch phân tích dựa trên thể tích dung dịch chuẩn đã dùng và nồng độ của nó.
Các Loại Bài Tập Chuẩn Độ Thường Gặp
Bài tập chuẩn độ rất đa dạng, từ đơn giản đến phức tạp, tùy thuộc vào loại phản ứng hóa học diễn ra. Dưới đây là một số loại bài tập chuẩn độ phổ biến:
- Chuẩn độ axit-bazơ: Xác định nồng độ của axit hoặc bazơ bằng dung dịch chuẩn bazơ hoặc axit tương ứng.
- Chuẩn độ oxy hóa-khử: Xác định nồng độ của chất oxy hóa hoặc chất khử bằng dung dịch chuẩn có tính chất ngược lại.
- Chuẩn độ tạo phức: Xác định nồng độ của ion kim loại bằng dung dịch chuẩn tạo phức.
- Chuẩn độ kết tủa: Xác định nồng độ của ion bằng dung dịch chuẩn tạo kết tủa.
 Bài tập chuẩn độ: Các loại
Bài tập chuẩn độ: Các loại
Mỗi loại bài tập chuẩn độ đều có phương pháp tính toán riêng, dựa trên phương trình phản ứng và hệ số cân bằng.
Phương Pháp Giải Bài Tập Chuẩn Độ Axit-Bazơ
Chuẩn độ axit-bazơ là loại bài tập chuẩn độ phổ biến nhất. Để giải bài tập này, ta cần nắm vững các bước sau:
- Viết phương trình phản ứng giữa axit và bazơ.
- Xác định tỉ lệ mol giữa axit và bazơ từ phương trình phản ứng.
- Tính số mol của chất đã biết (thường là dung dịch chuẩn).
- Sử dụng tỉ lệ mol để tính số mol của chất cần xác định.
- Tính nồng độ của chất cần xác định.
Ví dụ: Chuẩn độ 20ml dung dịch NaOH nồng độ 0.1M bằng dung dịch HCl nồng độ 0.1M. Tính thể tích dung dịch HCl cần dùng.
Giải:
- Phương trình phản ứng: HCl + NaOH → NaCl + H2O
- Tỉ lệ mol: nHCl : nNaOH = 1:1
- Số mol NaOH: nNaOH = 0.1 x 0.02 = 0.002 mol
- Số mol HCl: nHCl = nNaOH = 0.002 mol
- Thể tích HCl: VHCl = nHCl / CM HCl = 0.002 / 0.1 = 0.02 lít = 20ml
Sai Số Trong Chuẩn Độ Và Cách Khắc Phục
Trong quá trình thực hiện chuẩn độ, luôn tồn tại sai số. Các sai số thường gặp bao gồm:
- Sai số do đọc thể tích dung dịch.
- Sai số do chất chỉ thị.
- Sai số do thao tác.
 Bài tập chuẩn độ: Sai số
Bài tập chuẩn độ: Sai số
Để giảm thiểu sai số, cần thực hiện cẩn thận, đọc thể tích chính xác, lựa chọn chất chỉ thị phù hợp và thực hiện các thao tác đúng kỹ thuật.
GS.TS Nguyễn Văn A, chuyên gia hàng đầu về hóa phân tích, chia sẻ: “Việc nắm vững lý thuyết và thực hành thường xuyên là chìa khóa để thành thạo kỹ thuật chuẩn độ.”
Kết Luận
Bài tập chuẩn độ là một phần quan trọng trong hóa học phân tích. Hiểu rõ nguyên tắc, phương pháp tính toán và các yếu tố ảnh hưởng đến kết quả chuẩn độ sẽ giúp bạn giải quyết các bài tập một cách hiệu quả và chính xác.
FAQ
- Chuẩn độ là gì?
- Các loại chuẩn độ thường gặp là gì?
- Làm sao để chọn chất chỉ thị phù hợp?
- Sai số trong chuẩn độ là gì và cách khắc phục?
- Ứng dụng của chuẩn độ trong thực tế là gì?
- Làm sao để tính toán kết quả chuẩn độ?
- Tại sao cần phải thực hiện chuẩn độ?
Bạn có thể tìm hiểu thêm về các chủ đề liên quan như sartorius và đơn vị điện áp.
Khi cần hỗ trợ hãy liên hệ Email: [email protected], địa chỉ: Đường Nguyễn Văn Linh, Quận Hải Châu, Đà Nẵng, Việt Nam. Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.
