So Sánh Bán Kính Của Các Ion là một khía cạnh quan trọng trong hóa học, giúp dự đoán tính chất và phản ứng của các hợp chất. Bài viết này sẽ đi sâu vào phân tích và so sánh bán kính ion, cung cấp kiến thức cần thiết cho việc tìm hiểu về cấu trúc và tính chất của các chất.
Hiểu về Bán Kính Ion
Bán kính ion là khoảng cách từ hạt nhân đến lớp electron ngoài cùng của một ion. Kích thước của ion bị ảnh hưởng bởi số lớp electron, điện tích hạt nhân và số electron. Việc so sánh bán kính của các ion cho phép chúng ta hiểu rõ hơn về tương tác giữa các ion trong dung dịch và trong mạng tinh thể. Ví dụ, khi so sánh bán kính ion của Na+ và Cl-, ta có thể dự đoán được tính chất của muối NaCl.
Các Yếu Tố Ảnh Hưởng đến Bán Kính Ion
Có nhiều yếu tố ảnh hưởng đến bán kính của một ion. Một trong những yếu tố quan trọng nhất là điện tích của ion. Ion dương (cation) có bán kính nhỏ hơn nguyên tử trung hòa tương ứng do mất electron lớp ngoài cùng. Ngược lại, ion âm (anion) có bán kính lớn hơn nguyên tử trung hòa tương ứng do nhận thêm electron. Số lớp electron cũng đóng vai trò quan trọng. Ion có nhiều lớp electron sẽ có bán kính lớn hơn.
Điện Tích Hạt Nhân và Số Electron
Điện tích hạt nhân càng lớn thì lực hút giữa hạt nhân và electron càng mạnh, dẫn đến bán kính ion nhỏ hơn. Số electron cũng ảnh hưởng đến bán kính. Khi số electron tăng, bán kính ion cũng tăng.
 Ảnh hưởng của điện tích hạt nhân lên bán kính ion
Ảnh hưởng của điện tích hạt nhân lên bán kính ion
So sánh Bán kính Ion trong Cùng Chu Kỳ và Cùng Nhóm
Khi so sánh bán kính ion trong cùng chu kỳ, bán kính ion dương giảm dần từ trái sang phải, trong khi bán kính ion âm tăng dần từ trái sang phải. Trong cùng một nhóm, bán kính ion tăng dần từ trên xuống dưới. axit h2so4 có thể được sử dụng để minh họa cho việc so sánh bán kính ion.
Ví dụ về So sánh Bán kính Ion
Ví dụ, khi so sánh bán kính của các ion O2-, F-, Na+ và Mg2+, ta thấy O2- có bán kính lớn nhất, tiếp theo là F-, sau đó là Na+ và cuối cùng là Mg2+. Điều này là do O2- và F- là anion, trong khi Na+ và Mg2+ là cation. trị nấm cá đôi khi cũng liên quan đến các hợp chất ion.
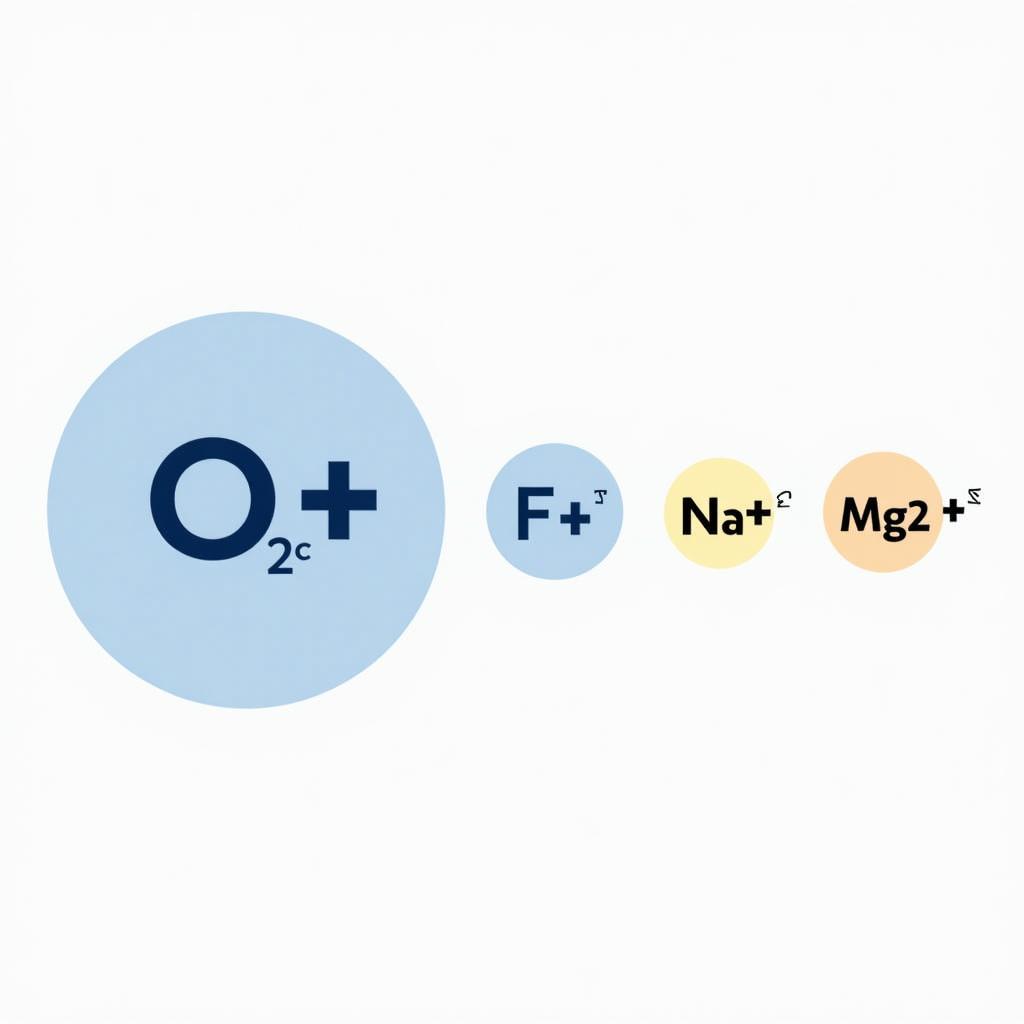 So sánh bán kính ion O2-, F-, Na+, Mg2+
So sánh bán kính ion O2-, F-, Na+, Mg2+
Kết luận
So sánh bán kính của các ion là một công cụ hữu ích để hiểu về tính chất của các hợp chất. Bằng cách phân tích các yếu tố ảnh hưởng đến bán kính ion, chúng ta có thể dự đoán được xu hướng thay đổi bán kính và từ đó dự đoán được tính chất của các hợp chất ion. c12h22o11 h2so4 đặc nóng là một phản ứng hóa học mà việc hiểu biết về bán kính ion có thể giúp ích.
FAQ
- Bán kính ion là gì?
- Yếu tố nào ảnh hưởng đến bán kính ion?
- Làm sao để so sánh bán kính ion trong cùng chu kỳ?
- Làm sao để so sánh bán kính ion trong cùng nhóm?
- Tại sao bán kính cation nhỏ hơn nguyên tử trung hòa?
- Tại sao bán kính anion lớn hơn nguyên tử trung hòa?
- Bán kính ion có ý nghĩa gì trong việc dự đoán tính chất của hợp chất?
Mô tả các tình huống thường gặp câu hỏi.
Các bạn học sinh thường gặp khó khăn trong việc xác định bán kính của ion khi so sánh các ion khác nhau. Ví dụ, việc so sánh bán kính giữa các ion cùng chu kỳ hay cùng nhóm.
Gợi ý các câu hỏi khác, bài viết khác có trong web.
Bạn có thể tìm hiểu thêm về ca no3 2 h2so4 và đương lượng gam của h2so4 trên trang web của chúng tôi.
