Phản ứng oxi hóa khử hữu cơ đóng vai trò quan trọng trong nhiều quá trình hóa học, từ sinh học đến công nghiệp. Việc nắm vững Cách Cân Bằng Phản ứng Oxi Hóa Khử Hữu Cơ là nền tảng thiết yếu cho bất kỳ ai học tập và nghiên cứu về hóa học. Bài viết này sẽ hướng dẫn bạn chi tiết về cách cân bằng phản ứng oxi hóa khử hữu cơ, từ cơ bản đến nâng cao.
Phương Pháp Cân Bằng Phản Ứng Oxi Hóa Khử Hữu Cơ Sử Dụng Số Oxi Hóa
Một trong những phương pháp phổ biến nhất để cân bằng phản ứng oxi hóa khử hữu cơ là sử dụng số oxi hóa. Phương pháp này dựa trên nguyên tắc bảo toàn số oxi hóa, tức là tổng số oxi hóa của các nguyên tố trước và sau phản ứng phải bằng nhau.
- Bước 1: Xác định số oxi hóa của các nguyên tố. Bắt đầu bằng việc xác định số oxi hóa của tất cả các nguyên tố tham gia phản ứng.
- Bước 2: Xác định chất oxi hóa và chất khử. Chất oxi hóa là chất có số oxi hóa giảm, còn chất khử là chất có số oxi hóa tăng.
- Bước 3: Viết bán phản ứng oxi hóa và bán phản ứng khử. Mỗi bán phản ứng thể hiện sự thay đổi số oxi hóa của một nguyên tố.
- Bước 4: Cân bằng số electron trao đổi. Nhân các bán phản ứng với hệ số thích hợp để số electron cho bằng số electron nhận.
- Bước 5: Cộng hai bán phản ứng lại. Sau khi cân bằng electron, cộng hai bán phản ứng lại để được phản ứng tổng quát.
- Bước 6: Cân bằng các nguyên tố còn lại. Cuối cùng, cân bằng các nguyên tố còn lại (thường là H và O) bằng cách thêm H₂O, H⁺ (trong môi trường axit) hoặc OH⁻ (trong môi trường bazơ).
Cân Bằng Phản Ứng Oxi Hóa Khử Hữu Cơ trong Môi Trường Axit và Bazơ
Việc cân bằng phản ứng oxi hóa khử hữu cơ trong môi trường axit và bazơ có sự khác biệt nhỏ. Trong môi trường axit, ta sử dụng H⁺ và H₂O để cân bằng, trong khi ở môi trường bazơ, ta sử dụng OH⁻ và H₂O.
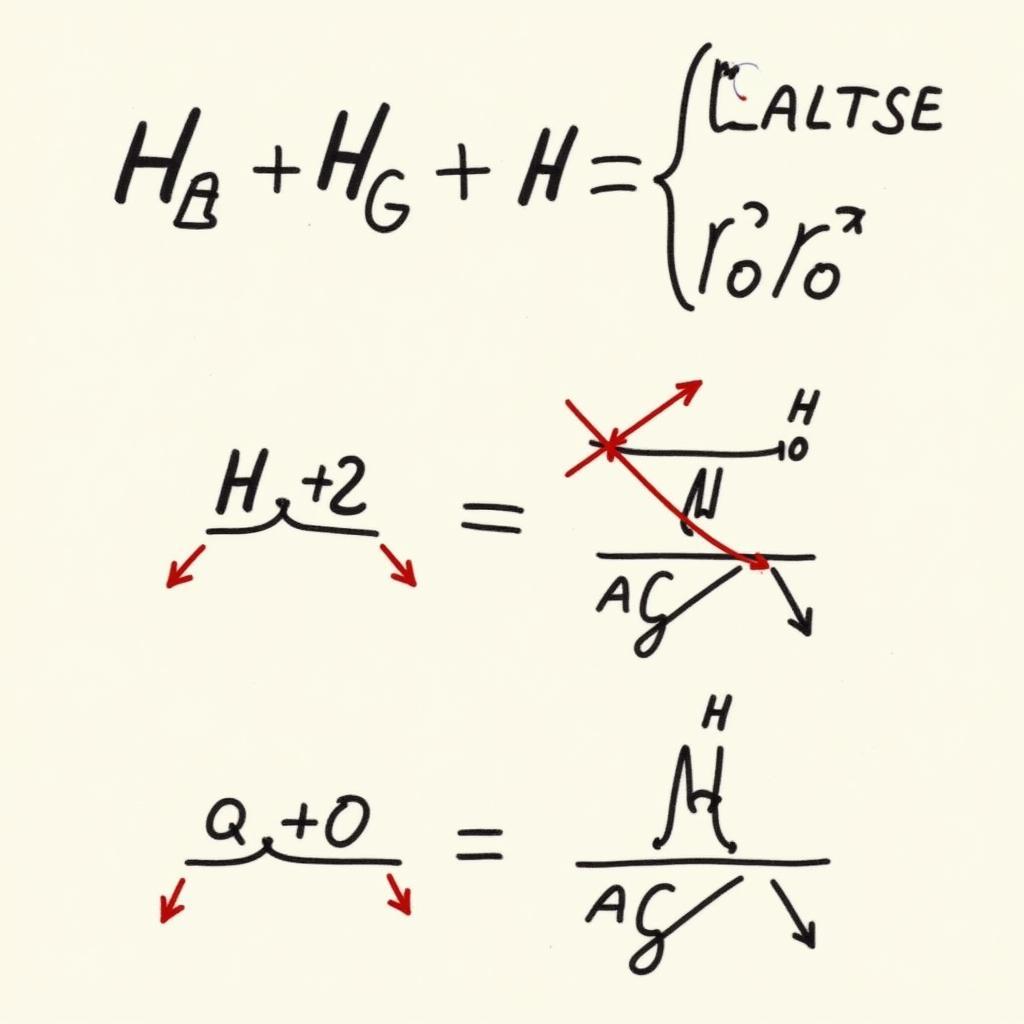 Cân bằng phản ứng oxi hóa khử hữu cơ trong môi trường axit
Cân bằng phản ứng oxi hóa khử hữu cơ trong môi trường axit
Ví dụ Cụ Thể về Cách Cân Bằng Phản Ứng Oxi Hóa Khử Hữu Cơ
Để hiểu rõ hơn, hãy xem xét ví dụ sau: Oxi hóa etanol (C₂H₅OH) thành axit axetic (CH₃COOH) bằng KMnO₄ trong môi trường axit.
- Bước 1: Xác định số oxi hóa. C trong C₂H₅OH là -2, C trong CH₃COOH là 0, Mn trong KMnO₄ là +7, Mn trong Mn²⁺ là +2.
- Bước 2: Xác định chất oxi hóa và chất khử. Etanol là chất khử, KMnO₄ là chất oxi hóa.
- Bước 3: Viết bán phản ứng.
- Oxi hóa: C₂H₅OH → CH₃COOH + 4H⁺ + 4e⁻
- Khử: MnO₄⁻ + 8H⁺ + 5e⁻ → Mn²⁺ + 4H₂O
- Bước 4: Cân bằng electron. Nhân bán phản ứng oxi hóa với 5 và bán phản ứng khử với 4.
- Bước 5 & 6: Cộng hai bán phản ứng và cân bằng các nguyên tố còn lại. 5C₂H₅OH + 4MnO₄⁻ + 12H⁺ → 5CH₃COOH + 4Mn²⁺ + 11H₂O
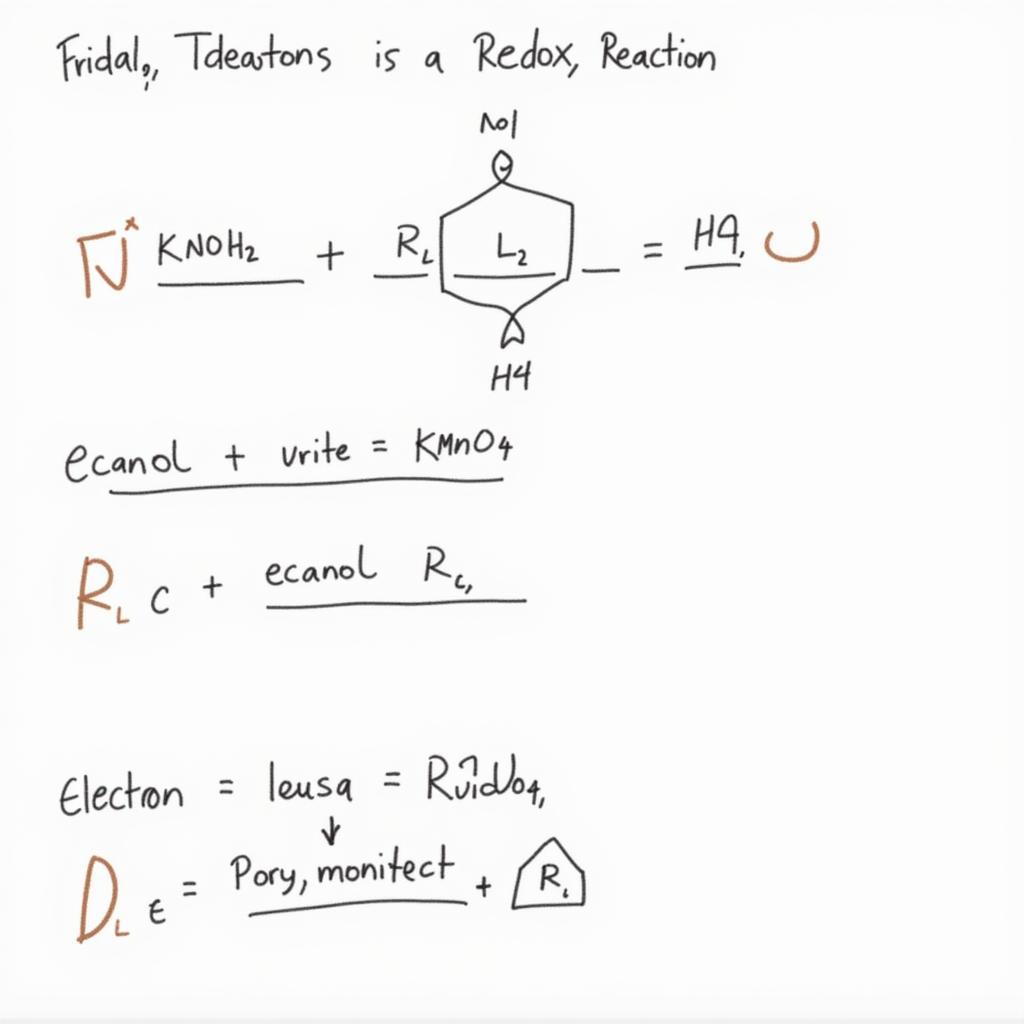 Ví dụ cân bằng phản ứng oxi hóa khử hữu cơ
Ví dụ cân bằng phản ứng oxi hóa khử hữu cơ
Những Sai Lầm Thường Gặp Khi Cân Bằng Phản Ứng Oxi Hóa Khử Hữu Cơ
Một số sai lầm phổ biến bao gồm quên xác định đúng số oxi hóa, không cân bằng số electron trao đổi, và quên cân bằng các nguyên tố khác ngoài nguyên tố thay đổi số oxi hóa.
Theo PGS.TS Nguyễn Văn A, chuyên gia hóa học hữu cơ tại Đại học Bách Khoa Hà Nội: “Việc nắm vững các quy tắc cơ bản và thực hành thường xuyên là chìa khóa để thành thạo kỹ năng cân bằng phản ứng oxi hóa khử hữu cơ.”
Kết luận
Cách cân bằng phản ứng oxi hóa khử hữu cơ đòi hỏi sự tỉ mỉ và chính xác. Hy vọng bài viết này đã cung cấp cho bạn những kiến thức cần thiết để tự tin xử lý các bài toán cân bằng phản ứng oxi hóa khử hữu cơ.
 Lời khuyên cân bằng phản ứng oxi hóa khử hữu cơ
Lời khuyên cân bằng phản ứng oxi hóa khử hữu cơ
FAQ
- Tại sao cần cân bằng phản ứng oxi hóa khử?
- Làm thế nào để xác định số oxi hóa của các nguyên tố trong hợp chất hữu cơ?
- Sự khác biệt giữa cân bằng phản ứng trong môi trường axit và bazơ là gì?
- Có những phương pháp nào khác để cân bằng phản ứng oxi hóa khử hữu cơ?
- Làm thế nào để tránh những sai lầm thường gặp khi cân bằng phản ứng?
- Ứng dụng của phản ứng oxi hóa khử hữu cơ trong đời sống là gì?
- Tài liệu nào hữu ích để học thêm về phản ứng oxi hóa khử hữu cơ?
Mô tả các tình huống thường gặp câu hỏi.
Người dùng thường gặp khó khăn trong việc xác định số oxi hóa của carbon trong các hợp chất hữu cơ phức tạp, cũng như cân bằng phản ứng trong môi trường bazơ.
Gợi ý các câu hỏi khác, bài viết khác có trong web.
Bạn có thể tìm hiểu thêm về các chủ đề liên quan như phản ứng cộng, phản ứng thế, và các loại phản ứng hữu cơ khác trên Friend LENS.
