Metan (CH₄), một hydrocarbon đơn giản nhất, đóng vai trò quan trọng trong đời sống và công nghiệp. Bài viết này sẽ đi sâu vào Tính Chất Hóa Học Của Metan, giúp bạn hiểu rõ hơn về khả năng phản ứng và ứng dụng của nó.
Phản ứng cháy của Metan
Metan là một chất khí dễ cháy, khi cháy tạo ra khí cacbon dioxit (CO₂) và nước (H₂O), đồng thời giải phóng một lượng nhiệt lớn. Phản ứng cháy hoàn toàn của metan được biểu diễn như sau:
CH₄ + 2O₂ → CO₂ + 2H₂O + Nhiệt
Phản ứng cháy của metan được ứng dụng rộng rãi trong đời sống, từ việc đun nấu, sưởi ấm đến sản xuất điện năng. 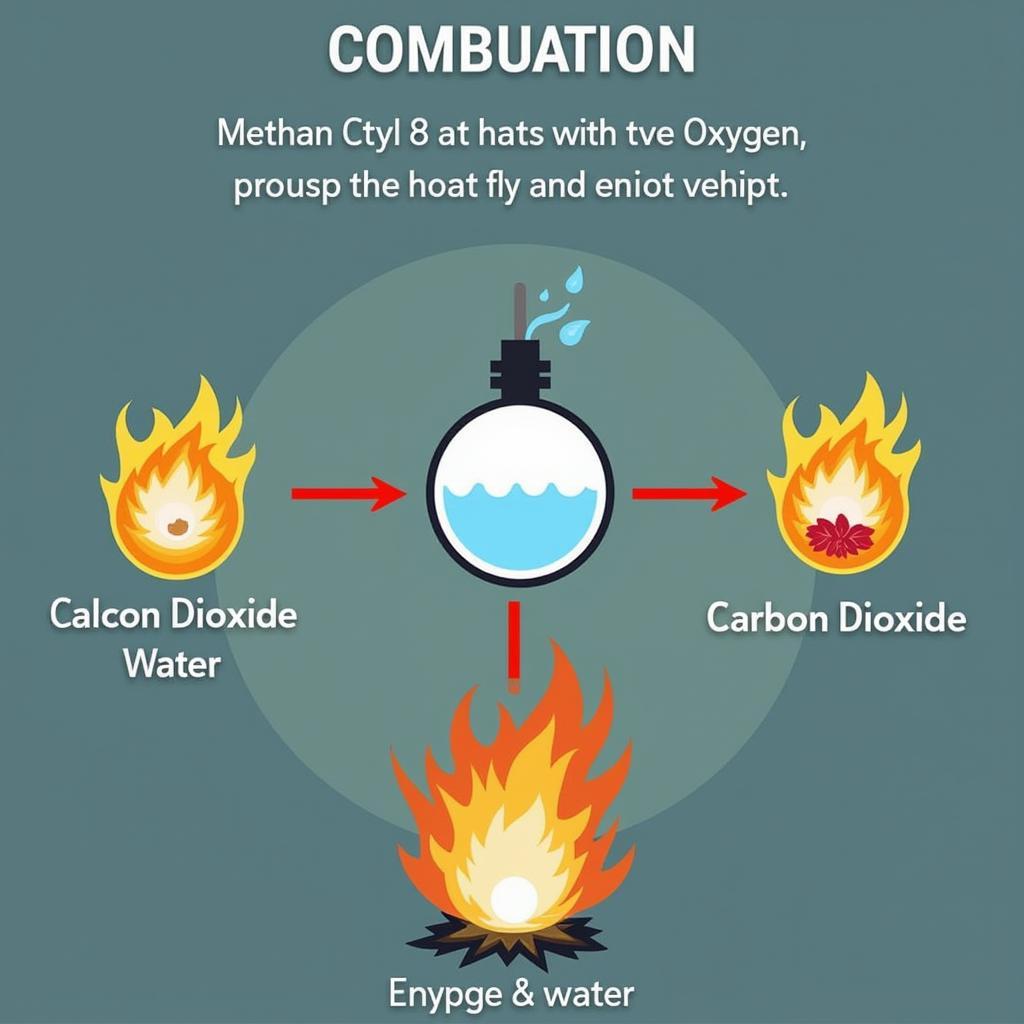 Phản ứng cháy của metan
Phản ứng cháy của metan
Liên kết C-H trong phân tử metan khá bền, do đó ở nhiệt độ thường, metan tương đối trơ. Tuy nhiên, ở nhiệt độ cao, metan có thể tham gia nhiều phản ứng hóa học quan trọng. pt điện li hclo
Phản ứng thế với Halogen
Một trong những tính chất hóa học đặc trưng của metan là phản ứng thế với halogen, đặc biệt là clo (Cl₂) và brom (Br₂). Phản ứng này diễn ra dưới ánh sáng hoặc nhiệt độ cao. Ví dụ, phản ứng của metan với clo:
CH₄ + Cl₂ → CH₃Cl + HCl (ánh sáng)
Sản phẩm tạo thành là metyl clorua (CH₃Cl) và hydro clorua (HCl). Phản ứng này có thể tiếp tục diễn ra cho đến khi tất cả nguyên tử hydro trong metan bị thay thế bởi clo, tạo thành các sản phẩm như diclometan (CH₂Cl₂), clorofom (CHCl₃) và cacbon tetraclorua (CCl₄).
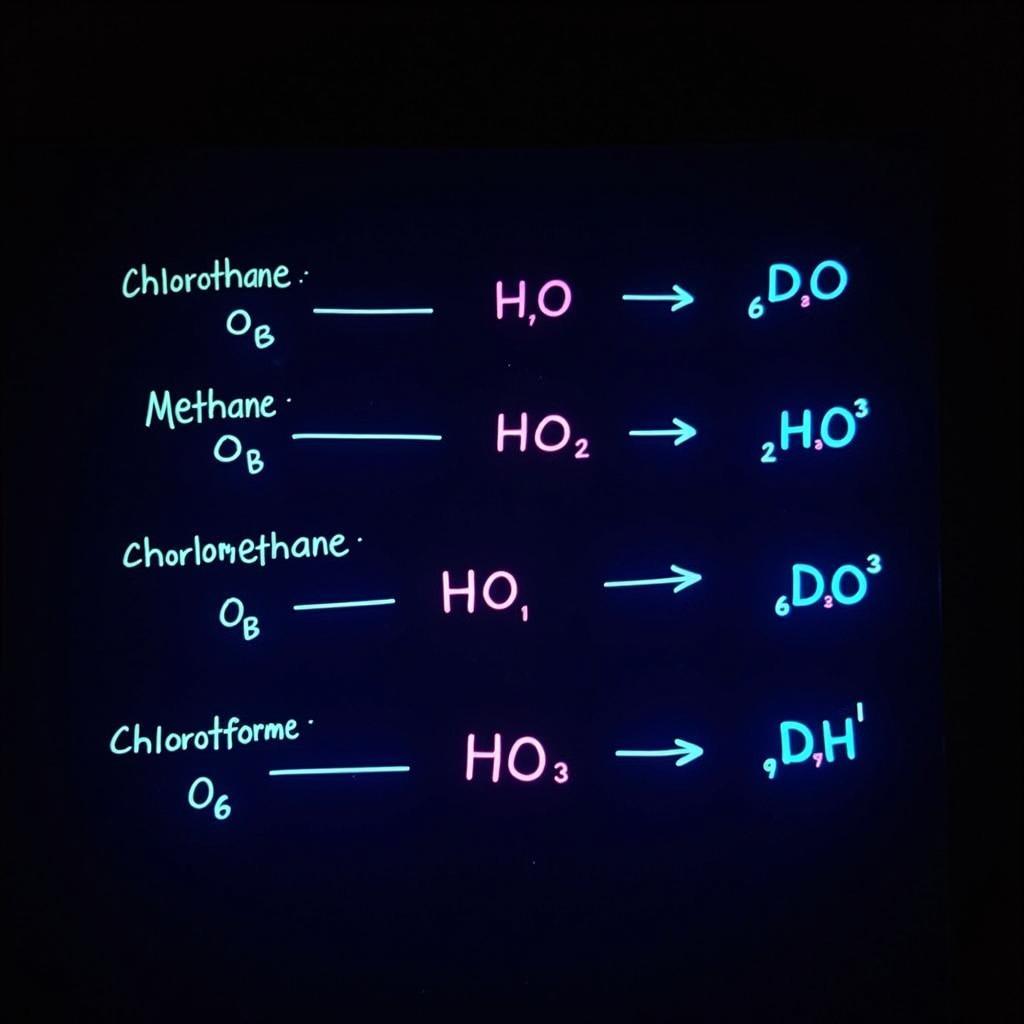 Phản ứng thế của metan với halogen
Phản ứng thế của metan với halogen
“Phản ứng thế với halogen là một trong những phản ứng quan trọng nhất của metan, mở ra cánh cửa cho việc tổng hợp nhiều hợp chất hữu cơ khác,” – TS. Nguyễn Văn An, chuyên gia hóa hữu cơ. bạc có tác dụng với oxi không
Cơ chế phản ứng thế
Phản ứng thế của metan với halogen diễn ra theo cơ chế gốc tự do, bao gồm ba giai đoạn chính: khơi mào, phát triển mạch và kết thúc mạch.
- Khơi mào: Phân tử halogen bị phân cắt thành hai gốc tự do halogen dưới tác dụng của ánh sáng hoặc nhiệt.
- Phát triển mạch: Gốc tự do halogen phản ứng với metan, tạo thành gốc metyl và hydro halogenua. Gốc metyl sau đó phản ứng với phân tử halogen, tạo thành sản phẩm thế và một gốc halogen mới, tiếp tục chuỗi phản ứng.
- Kết thúc mạch: Hai gốc tự do kết hợp với nhau, làm dừng chuỗi phản ứng.
Phản ứng nhiệt phân
Ở nhiệt độ cao (khoảng 1500°C), metan bị nhiệt phân thành cacbon và hydro:
CH₄ → C + 2H₂
Phản ứng này là một phương pháp sản xuất hydro trong công nghiệp. tơ hoá học điều chế hidro trong phòng thí nghiệm phản ứng thế
 Phản ứng nhiệt phân metan
Phản ứng nhiệt phân metan
“Việc kiểm soát nhiệt độ trong quá trình nhiệt phân metan là rất quan trọng để tối ưu hóa sản lượng hydro,” – PGS. TS. Trần Thị Mai, chuyên gia hóa lý.
Kết luận
Tính chất hóa học của metan, đặc biệt là phản ứng cháy và phản ứng thế, đóng vai trò then chốt trong nhiều ứng dụng công nghiệp và đời sống. Hiểu rõ về tính chất hóa học của metan giúp chúng ta khai thác và sử dụng nguồn tài nguyên này một cách hiệu quả và an toàn. muối tinh là gì
FAQ
- Metan có độc không?
- Ứng dụng của metan trong đời sống là gì?
- Làm thế nào để điều chế metan trong phòng thí nghiệm?
- Tại sao metan được coi là khí nhà kính?
- Phản ứng của metan với clo diễn ra như thế nào?
- Metan có tan trong nước không?
- Phân biệt metan với các hydrocarbon khác như thế nào?
Mô tả các tình huống thường gặp câu hỏi
Người ta thường thắc mắc về tính an toàn của việc sử dụng metan, ứng dụng của nó trong công nghiệp và đời sống, cũng như tác động của metan đến môi trường.
Gợi ý các câu hỏi khác, bài viết khác có trong web.
Bạn có thể tìm hiểu thêm về các hydrocarbon khác như etan, propan, butan trên website của chúng tôi.
