Công Thức Lewis Của So3 là một chủ đề quan trọng trong hóa học, giúp chúng ta hiểu rõ về cấu trúc và tính chất của phân tử sulfur trioxide. Bài viết này sẽ đi sâu vào phân tích công thức Lewis của SO3, cùng với các khía cạnh liên quan, hình dạng phân tử, và ứng dụng của nó trong thực tế.
Hiểu Rõ Về Công Thức Lewis
Công thức Lewis, còn được gọi là cấu trúc Lewis, là một biểu diễn đồ họa đơn giản về cấu trúc điện tử của một phân tử. Nó cho thấy cách các electron hóa trị được phân bố giữa các nguyên tử trong phân tử, bao gồm các cặp electron liên kết và cặp electron tự do. Việc hiểu rõ công thức Lewis là nền tảng để dự đoán hình dạng phân tử, tính chất hóa học và phản ứng của hợp chất.
Vẽ Công Thức Lewis Của SO3
Để vẽ công thức Lewis của SO3, chúng ta cần tuân theo các bước sau:
-
Xác định tổng số electron hóa trị: Sulfur (S) có 6 electron hóa trị và oxy (O) cũng có 6 electron hóa trị. Vì SO3 có một nguyên tử S và ba nguyên tử O, tổng số electron hóa trị là 6 + 3*6 = 24.
-
Chọn nguyên tử trung tâm: Nguyên tử có độ âm điện thấp nhất thường là nguyên tử trung tâm. Trong trường hợp này, sulfur (S) là nguyên tử trung tâm.
-
Nối các nguyên tử bằng liên kết đơn: Nối nguyên tử S với ba nguyên tử O bằng ba liên kết đơn. Điều này sử dụng 6 electron (3 liên kết x 2 electron/liên kết).
-
Phân bố các electron còn lại: Chúng ta còn lại 18 electron (24 – 6). Phân bố các electron này lên các nguyên tử O sao cho mỗi nguyên tử O đạt được cấu hình octet (8 electron lớp ngoài cùng).
-
Kiểm tra quy tắc octet: Sau khi phân bố, ta thấy nguyên tử S chỉ có 6 electron. Để đạt được octet, ta cần tạo liên kết đôi giữa S và một trong các nguyên tử O. Tuy nhiên, SO3 có thể tạo ra ba liên kết đôi với ba nguyên tử oxy, tạo thành cấu trúc cộng hưởng.
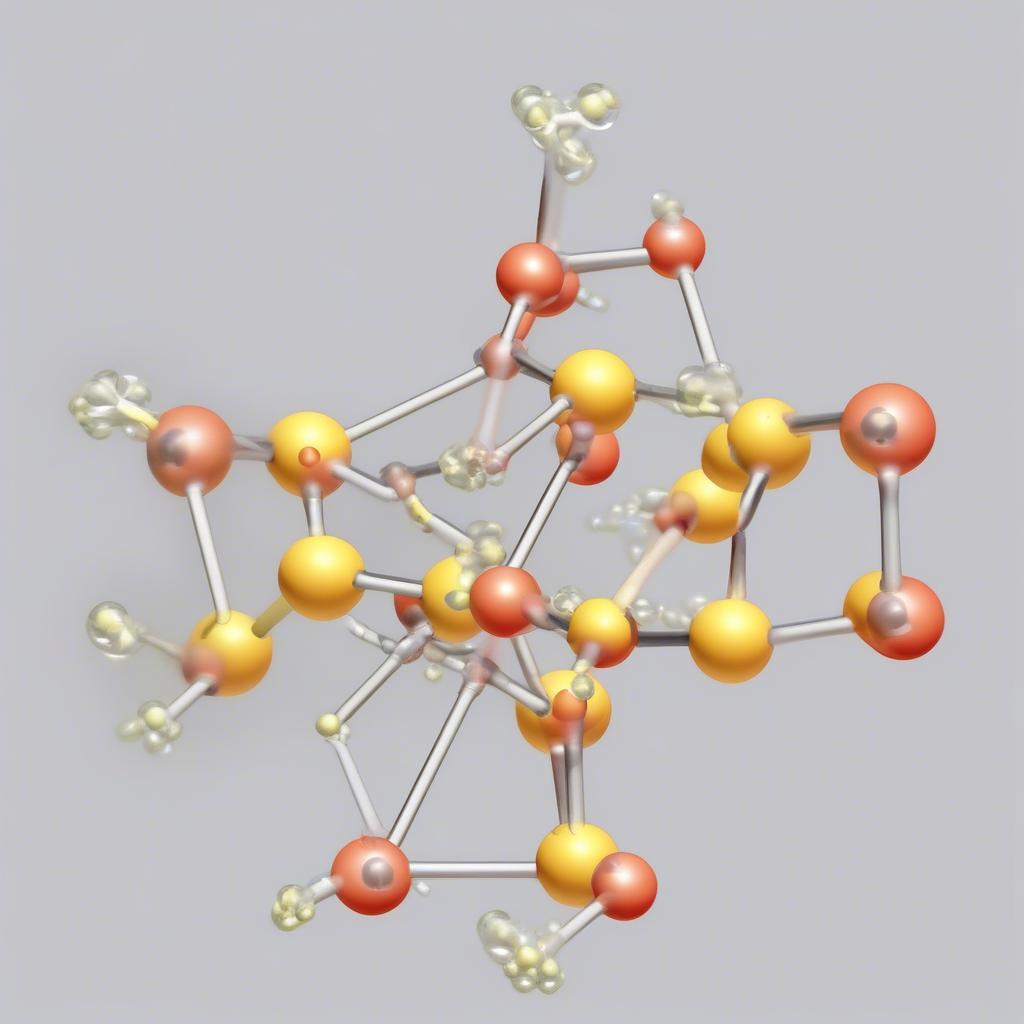 Công thức Lewis của SO3
Công thức Lewis của SO3
Cấu Trúc Cộng Hưởng Của SO3
SO3 thể hiện tính cộng hưởng, nghĩa là phân tử không tồn tại ở một cấu trúc Lewis cố định nào cả. Thay vào đó, nó là sự kết hợp của ba cấu trúc Lewis, trong đó liên kết đôi luân phiên giữa nguyên tử S và ba nguyên tử O. Cấu trúc cộng hưởng giúp phân tử SO3 ổn định hơn.
Hình Dạng Phân Tử SO3
Dựa trên thuyết VSEPR (Valence Shell Electron Pair Repulsion), SO3 có hình dạng phân tử phẳng tam giác. Các nguyên tử O nằm ở ba đỉnh của tam giác đều, với nguyên tử S ở trung tâm. Góc liên kết giữa các nguyên tử O-S-O là 120 độ.
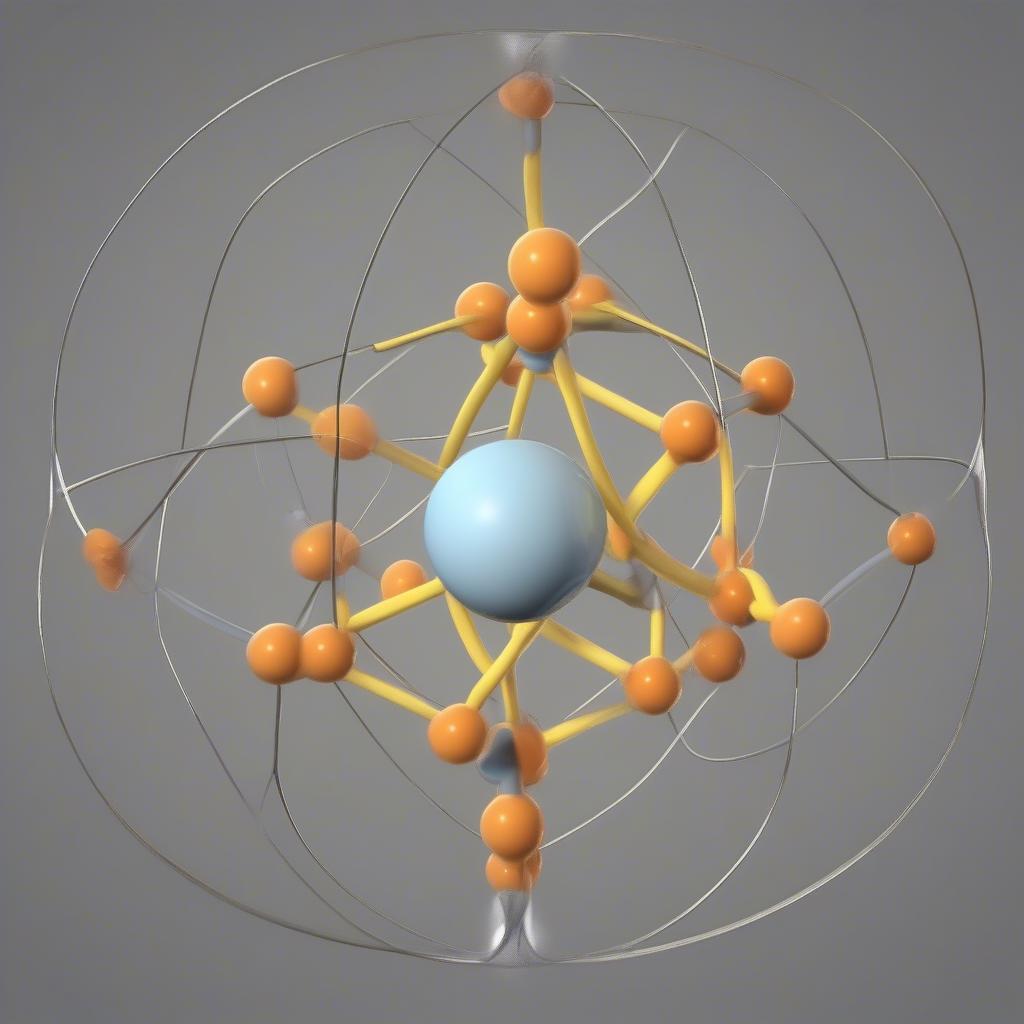 Hình dạng phân tử SO3
Hình dạng phân tử SO3
Ứng Dụng Của SO3
SO3 là một chất trung gian quan trọng trong sản xuất axit sulfuric (H2SO4), một trong những hóa chất được sử dụng rộng rãi nhất trong công nghiệp. Nó cũng được sử dụng trong sản xuất thuốc nhuộm, chất tẩy rửa, và các sản phẩm hóa học khác.
Kết luận
Công thức lewis của SO3 cho thấy cấu trúc phân tử phẳng tam giác với ba liên kết đôi S=O và tính cộng hưởng. Hiểu rõ về công thức Lewis của SO3 là rất quan trọng để nắm bắt tính chất và ứng dụng của hợp chất này trong đời sống và sản xuất công nghiệp.
FAQ
-
Tại sao SO3 có cấu trúc cộng hưởng? SO3 có cấu trúc cộng hưởng để phân bố đều mật độ electron, làm cho phân tử ổn định hơn.
-
Hình dạng phân tử của SO3 là gì? SO3 có hình dạng phân tử phẳng tam giác.
-
Ứng dụng chính của SO3 là gì? SO3 được sử dụng chủ yếu để sản xuất axit sulfuric (H2SO4).
-
Làm thế nào để vẽ công thức Lewis của SO3? Bằng cách xác định tổng số electron hóa trị, chọn nguyên tử trung tâm, nối các nguyên tử bằng liên kết đơn, phân bố các electron còn lại và kiểm tra quy tắc octet.
-
Góc liên kết trong phân tử SO3 là bao nhiêu? Góc liên kết O-S-O trong SO3 là 120 độ.
-
Tại sao việc hiểu công thức Lewis lại quan trọng? Công thức Lewis giúp dự đoán hình dạng phân tử, tính chất hóa học và phản ứng của hợp chất.
-
SO3 có độc hại không? SO3 là chất rất phản ứng và có thể gây kích ứng da, mắt và đường hô hấp.
 Ứng dụng của SO3
Ứng dụng của SO3
Bạn có thắc mắc gì về Công thức Lewis và các hợp chất khác?
Hãy khám phá thêm các bài viết khác trên Friend LENS về các chủ đề liên quan đến hóa học và các hợp chất hóa học.
Cần Hỗ Trợ?
Khi cần hỗ trợ hãy liên hệ Email: [email protected], địa chỉ: Đường Nguyễn Văn Linh, Quận Hải Châu, Đà Nẵng, Việt Nam. Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.
