Phân tử nitơ (N2) là một trong những phân tử phổ biến nhất trong khí quyển Trái Đất. Vậy N2 Là Liên Kết Gì? Bài viết này sẽ đi sâu vào phân tích bản chất liên kết hóa học trong phân tử N2, từ đó giúp bạn hiểu rõ hơn về tính chất và ứng dụng của nó.
Bản chất liên kết trong phân tử N2
Nitơ (N) là nguyên tố phi kim thuộc nhóm VA, có 5 electron lớp ngoài cùng. Để đạt được cấu hình electron bền vững giống khí hiếm, mỗi nguyên tử nitơ cần thêm 3 electron. Trong phân tử N2, hai nguyên tử nitơ chia sẻ 3 cặp electron với nhau, tạo thành liên kết ba cộng hóa trị. Liên kết ba này rất bền vững, khiến N2 trở nên khá trơ về mặt hóa học. 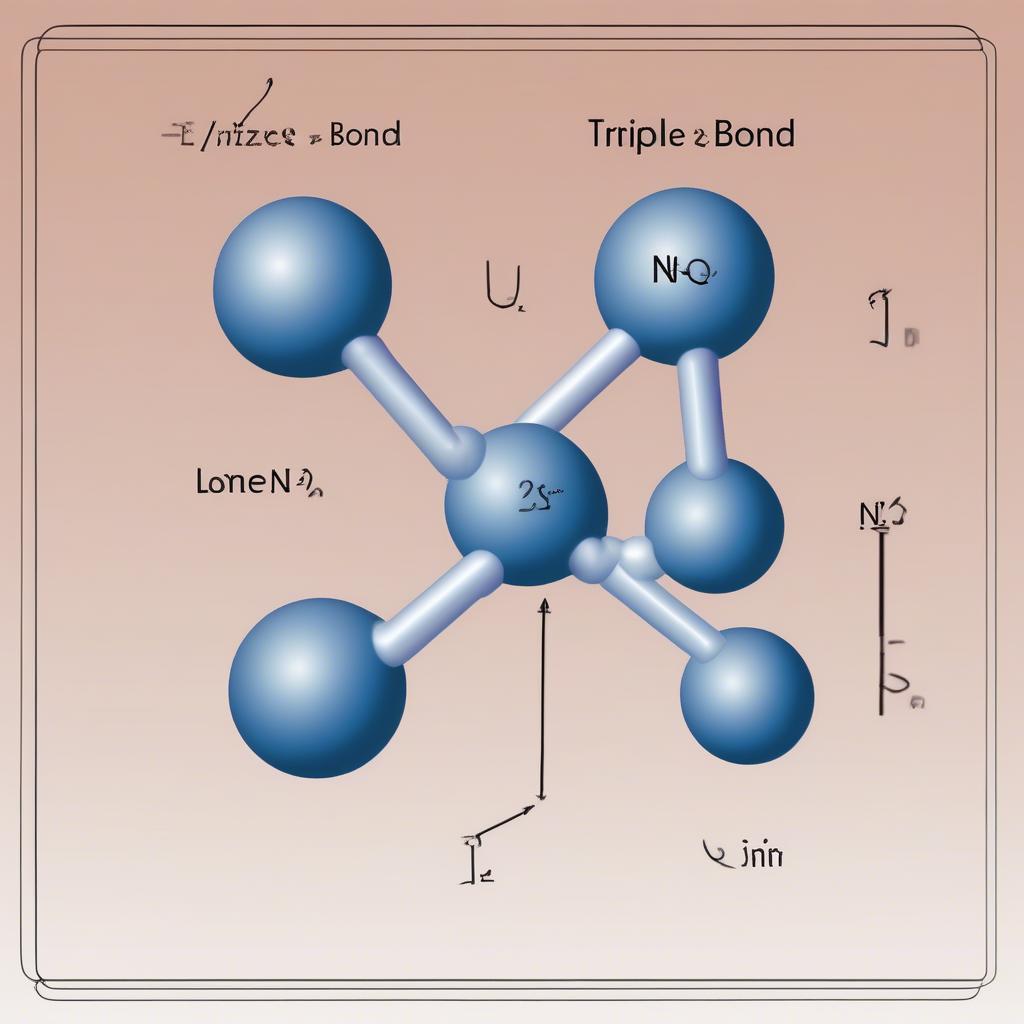 Liên kết ba trong phân tử N2
Liên kết ba trong phân tử N2
Chính liên kết ba mạnh mẽ này giải thích tại sao nitơ ở điều kiện thường tồn tại ở dạng khí, khó tham gia phản ứng hóa học và đòi hỏi năng lượng cao để phá vỡ liên kết. Ví dụ, việc chuyển đổi n2 ra no đòi hỏi điều kiện phản ứng đặc biệt. Liên kết ba trong N2 là một ví dụ điển hình cho liên kết cộng hóa trị không phân cực, bởi vì hai nguyên tử nitơ có độ âm điện bằng nhau.
Ảnh hưởng của liên kết ba đến tính chất của N2
Liên kết ba trong N2 ảnh hưởng mạnh mẽ đến tính chất vật lý và hóa học của nó. Do liên kết ba rất bền vững, N2 có nhiệt độ sôi và nhiệt độ nóng chảy rất thấp.  Tính chất của N2 Điều này khiến nitơ tồn tại ở dạng khí trong điều kiện thường. Ngoài ra, N2 ít tan trong nước và có khối lượng riêng nhỏ hơn không khí.
Tính chất của N2 Điều này khiến nitơ tồn tại ở dạng khí trong điều kiện thường. Ngoài ra, N2 ít tan trong nước và có khối lượng riêng nhỏ hơn không khí.
Về mặt hóa học, N2 khá trơ, chỉ phản ứng với một số chất ở nhiệt độ và áp suất cao. Ví dụ như phản ứng tạo thành amoniac (NH3) từ N2 và H2 cần xúc tác và điều kiện nhiệt độ, áp suất thích hợp. Bạn có thể tìm hiểu thêm về n2h4, một hợp chất khác của nitơ, để thấy sự đa dạng trong hóa học của nitơ.
“Liên kết ba trong phân tử N2 là một trong những liên kết mạnh nhất trong hóa học vô cơ,” Tiến sĩ Nguyễn Văn An, chuyên gia hóa học tại Đại học Quốc gia Hà Nội, cho biết. “Điều này giải thích tại sao N2 rất khó tham gia phản ứng hóa học.”
Ứng dụng của N2 trong đời sống và công nghiệp
Mặc dù khá trơ, N2 vẫn có nhiều ứng dụng quan trọng. Trong công nghiệp, N2 được sử dụng để tổng hợp amoniac (NH3), sản xuất axit nitric (hno3 là liên kết gì), và làm môi trường bảo vệ trong luyện kim. Trong đời sống, N2 lỏng được dùng làm chất làm lạnh, bảo quản thực phẩm. “Việc hiểu rõ về liên kết 3 trong phân tử N2 là chìa khóa để ứng dụng nó một cách hiệu quả,” Thạc sĩ Phạm Thị Lan, chuyên gia nghiên cứu tại Viện Hóa học, chia sẻ.
 Ứng dụng của N2
Ứng dụng của N2
Kết luận
Tóm lại, N2 là phân tử được hình thành bởi liên kết ba cộng hóa trị giữa hai nguyên tử nitơ. Liên kết này rất bền vững, ảnh hưởng đến tính chất và ứng dụng của N2. Hiểu rõ về “n2 là liên kết gì” giúp chúng ta khai thác hiệu quả hơn tiềm năng của phân tử quan trọng này. Xem thêm về công thức cấu tạo n2 để hiểu rõ hơn về cấu trúc phân tử này.
FAQ
- Tại sao N2 khá trơ về mặt hóa học?
- Liên kết trong N2 là loại liên kết gì?
- N2 có những ứng dụng gì trong công nghiệp?
- Tại sao N2 tồn tại ở dạng khí ở điều kiện thường?
- N2 có tan trong nước không?
- N2 có độc hại không?
- Làm thế nào để phá vỡ liên kết ba trong N2?
Mô tả các tình huống thường gặp câu hỏi.
Người dùng thường thắc mắc về bản chất liên kết trong N2, tính chất và ứng dụng của nó. Một số còn nhầm lẫn giữa liên kết trong N2 với các loại liên kết khác.
Gợi ý các câu hỏi khác, bài viết khác có trong web.
Bạn có thể tìm hiểu thêm về các hợp chất khác của nitơ như NH3, N2O, HNO3 trên website.
