Cấu hình electron của K (Kali) là một chủ đề quan trọng trong hóa học, giúp chúng ta hiểu được tính chất và khả năng phản ứng của nguyên tố này. Trong 50 từ đầu tiên này, chúng ta sẽ cùng nhau khám phá chi tiết về Cấu Hình E Của K và những ứng dụng thú vị của nó.
Cấu Hình Electron của K Là Gì?
Cấu hình electron của một nguyên tử mô tả sự phân bố của các electron trong các lớp và phân lớp electron. Đối với Kali (K), cấu hình electron là gì, với số hiệu nguyên tử là 19, cấu hình electron của nó được viết là 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹. Điều này có nghĩa là Kali có 19 electron được phân bố trong các lớp và phân lớp khác nhau.
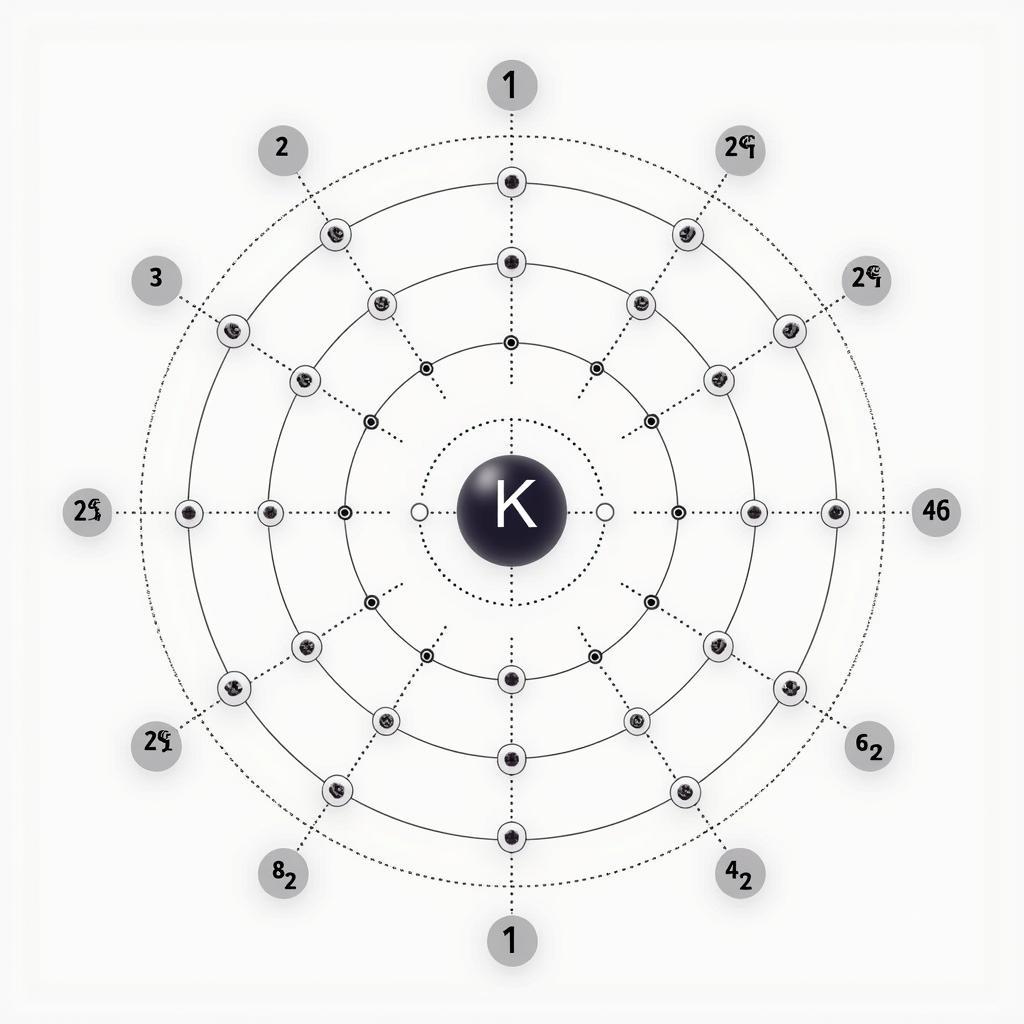 Cấu hình electron của Kali
Cấu hình electron của Kali
Phân Tích Chi Tiết Cấu Hình E Của K
Cấu hình electron 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹ của K cho thấy electron cuối cùng nằm ở lớp thứ 4, phân lớp s. Electron này, được gọi là electron hóa trị, đóng vai trò quan trọng trong các phản ứng hóa học của Kali. Vì chỉ có một electron ở lớp ngoài cùng, Kali có xu hướng mất electron này để đạt được cấu hình electron bền vững của khí hiếm Argon (Ar). Chính vì vậy, Kali là một kim loại kiềm rất hoạt động, dễ dàng phản ứng với nhiều chất khác. cấu hình electron của nguyên tử biểu diễn như thế nào cho các nguyên tố khác?
Tại Sao Cấu Hình Electron của K lại là 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹?
Nguyên tắc Aufbau quy định rằng các electron sẽ lấp đầy các orbital nguyên tử theo thứ tự năng lượng tăng dần. Trong trường hợp của Kali, orbital 4s có năng lượng thấp hơn orbital 3d, do đó electron thứ 19 sẽ lấp đầy orbital 4s trước.
“Việc hiểu rõ cấu hình electron của Kali là nền tảng để nắm bắt các tính chất hóa học của nó,” – TS. Nguyễn Văn An, chuyên gia hóa học vô cơ.
Ứng Dụng Của Cấu Hình E Của K Trong Đời Sống
Kiến thức về cấu hình e của ca và K giúp ta hiểu được tính chất và ứng dụng của chúng. Do tính hoạt động mạnh, Kali được sử dụng rộng rãi trong sản xuất phân bón, là nguồn cung cấp Kali cho cây trồng. Ngoài ra, các hợp chất của Kali cũng được ứng dụng trong nhiều lĩnh vực khác như y học, công nghiệp thực phẩm.
Cấu Hình Electron và Phản Ứng Hóa Học của Kali
Như đã đề cập, electron hóa trị duy nhất trong cấu hình e của K khiến nó dễ dàng mất electron và tạo thành ion K⁺. Điều này giải thích tại sao Kali phản ứng mạnh với nước, tạo ra khí hydro và dung dịch kiềm.
“Cấu hình electron không chỉ là một khái niệm lý thuyết mà còn có ứng dụng thực tiễn rất quan trọng.” – PGS. Trần Thị Bình, chuyên gia hóa học vật liệu.
Kết luận
Cấu hình electron của K (1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹) giải thích tính chất hóa học hoạt động của nguyên tố này. Hiểu rõ 1s2 2s2 và các cấu hình khác là chìa khóa để khám phá thế giới hóa học. Từ việc sản xuất phân bón đến ứng dụng trong y học, cấu hình e của K đóng vai trò quan trọng trong nhiều lĩnh vực của đời sống.
FAQ
- Cấu hình electron của K là gì? (1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹)
- Electron hóa trị của K là bao nhiêu? (1)
- Tại sao Kali lại là kim loại kiềm hoạt động mạnh? (Do dễ dàng mất electron hóa trị)
- Ứng dụng của Kali trong đời sống là gì? (Sản xuất phân bón, y học, công nghiệp thực phẩm)
- Nguyên tắc nào quyết định thứ tự lấp đầy electron trong cấu hình electron? (Nguyên tắc Aufbau)
- Cấu hình electron lớp ngoài cùng của nhóm halogen là gì?
- Sự khác biệt giữa cấu hình electron của K và Ca là gì?
Mô tả các tình huống thường gặp câu hỏi.
Sinh viên thường gặp khó khăn trong việc viết và hiểu cấu hình electron. Nhiều người nhầm lẫn giữa các lớp và phân lớp. Việc xác định số electron hóa trị cũng là một thách thức.
Gợi ý các câu hỏi khác, bài viết khác có trong web.
Bạn có thể tìm hiểu thêm về cấu hình electron của các nguyên tố khác, nguyên tắc Aufbau, và bảng tuần hoàn.
