Hidro sunfua (H2S) là một axit yếu, có mùi trứng thối đặc trưng. Việc tìm hiểu Pt điện Li H2s là bước quan trọng để nắm vững tính chất hóa học của hợp chất này. Bài viết này sẽ phân tích chi tiết phương trình điện li của H2S, các yếu tố ảnh hưởng, cũng như ứng dụng của nó trong thực tế.
H2S Điện Li Như Thế Nào?
H2S là một diacid, nghĩa là nó có thể phân li theo hai nấc. Phương trình điện li h2s được biểu diễn qua hai giai đoạn:
- Giai đoạn 1: H2S (aq) <=> H+ (aq) + HS- (aq) Đây là giai đoạn điện li mạnh hơn, tạo ra ion hidrosunfua (HS-).
- Giai đoạn 2: HS- (aq) <=> H+ (aq) + S2- (aq) Giai đoạn này diễn ra yếu hơn, tạo ra ion sunfua (S2-).
Do giai đoạn 2 diễn ra rất yếu, nồng độ ion S2- thường rất nhỏ. Vì vậy, khi xét đến pt điện li h2s, người ta thường chỉ xét đến giai đoạn điện li thứ nhất.
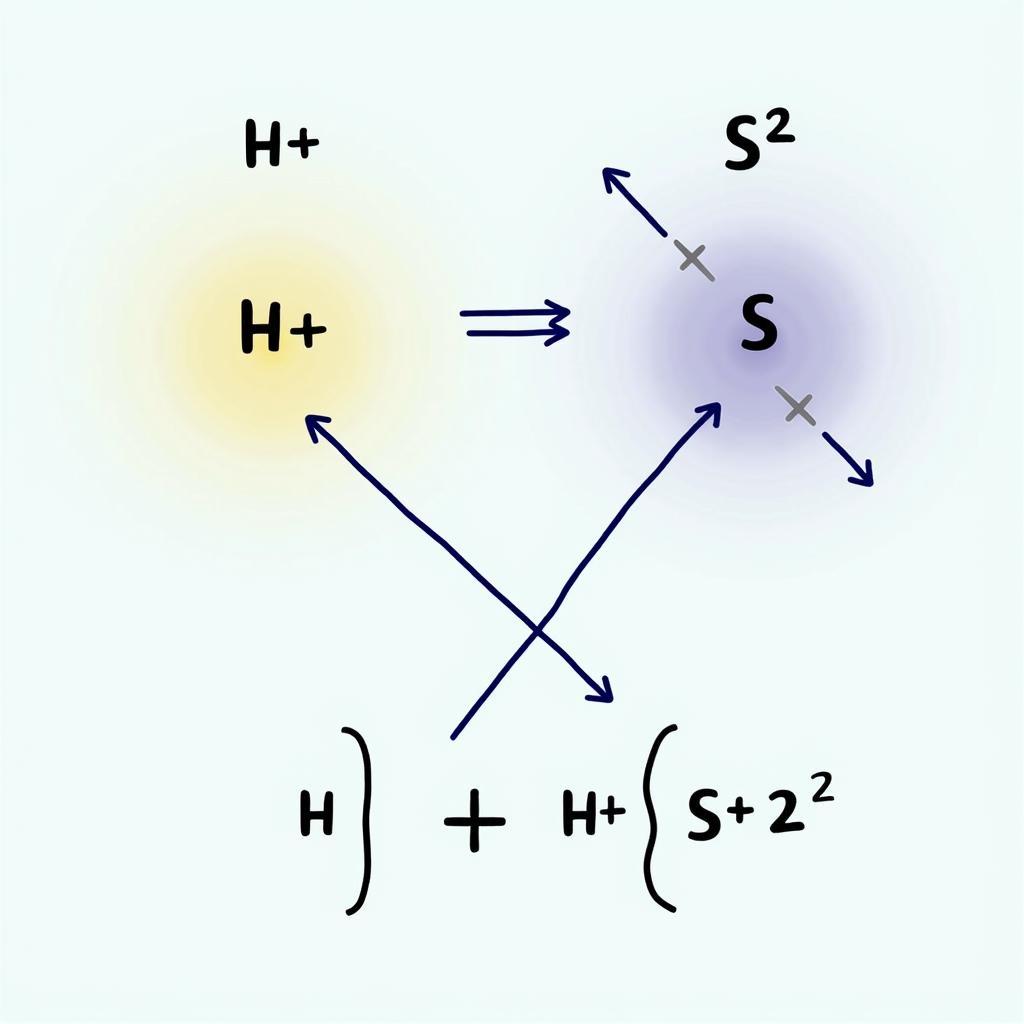 Phương trình điện li H2S giai đoạn 2
Phương trình điện li H2S giai đoạn 2
Các Yếu Tố Ảnh Hưởng Đến Phương Trình Điện Li H2S
Phương trình điện li h2s chịu ảnh hưởng bởi một số yếu tố sau:
- Nồng độ H2S: Nồng độ H2S càng cao, quá trình điện li càng diễn ra mạnh mẽ hơn, tuy nhiên, độ điện li lại giảm.
- Nhiệt độ: Nhiệt độ cao hơn làm tăng tốc độ phản ứng, do đó quá trình điện li diễn ra nhanh hơn.
- pH của dung dịch: pH của dung dịch ảnh hưởng đến cân bằng điện li của H2S. Trong môi trường kiềm, H2S dễ dàng điện li hơn. viết phương trình điện li của hclo
- Sự có mặt của các ion khác: Sự hiện diện của các ion khác trong dung dịch, đặc biệt là các ion cùng loại, có thể ảnh hưởng đến cân bằng điện li của H2S.
Ứng Dụng Của H2S và Phương Trình Điện Li
Hiểu rõ pt điện li h2s giúp ứng dụng hợp chất này hiệu quả hơn trong nhiều lĩnh vực:
- Phân tích định tính: Dựa vào tính chất tạo kết tủa với nhiều kim loại nặng, H2S được sử dụng để nhận biết và phân tích định tính các ion kim loại.
- Điều chế sunfua kim loại: Phương trình điện li h2s cho thấy sự tồn tại của ion S2-, ion này có thể phản ứng với các ion kim loại tạo thành sunfua kim loại, được ứng dụng trong sản xuất nhiều vật liệu. h2so4 loãng không tác dụng với chất nào
- Ngành công nghiệp dầu khí: H2S là một tạp chất thường có trong dầu khí, cần được loại bỏ để tránh ăn mòn thiết bị.
Kết luận
Phương trình điện li h2s là một khái niệm cơ bản nhưng quan trọng trong hóa học. Hiểu rõ pt điện li h2s giúp chúng ta nắm bắt tính chất của H2S và ứng dụng nó hiệu quả trong thực tế. phương trình điện li hcl Việc nghiên cứu sâu hơn về pt điện li h2s sẽ mở ra nhiều cơ hội ứng dụng mới cho hợp chất này. các kim loại không tác dụng với h2so4 đặc nóng dãy điện hóa của kim loại
FAQ
- H2S có phải là axit mạnh không?
- H2S có mùi gì?
- H2S có độc hại không?
- Làm thế nào để nhận biết H2S?
- Ứng dụng của H2S trong đời sống là gì?
- Tại sao cần hiểu về pt điện li h2s?
- H2S có tan trong nước không?
Mô tả các tình huống thường gặp câu hỏi về pt điện li h2s
- Học sinh gặp khó khăn khi viết pt điện li h2s.
- Cần giải thích chi tiết về hai nấc điện li của H2S.
- Muốn tìm hiểu ảnh hưởng của pH đến quá trình điện li H2S.
Gợi ý các câu hỏi khác, bài viết khác có trong web.
- Xem thêm về axit mạnh và axit yếu.
- Tìm hiểu về các hợp chất sunfua khác.
- Đọc thêm về ứng dụng của H2S trong công nghiệp.
