Các Công Thức Hóa Học 8 là nền tảng quan trọng cho việc học tập môn Hóa học ở cấp trung học cơ sở. Nắm vững các công thức này không chỉ giúp bạn đạt điểm cao trong các bài kiểm tra mà còn giúp bạn hiểu sâu hơn về thế giới xung quanh. Bài viết này sẽ cung cấp cho bạn một hướng dẫn chi tiết về các công thức hóa học lớp 8, kèm theo ví dụ minh họa và các mẹo ghi nhớ hiệu quả.
Công Thức Tính Khối Lượng Mol
Công thức tính khối lượng mol (M) của một chất được tính bằng tổng khối lượng nguyên tử của các nguyên tố trong công thức hóa học của chất đó. Ví dụ, khối lượng mol của nước (H₂O) được tính như sau: M(H₂O) = 2 M(H) + M(O) = 2 1 + 16 = 18 g/mol. Việc hiểu rõ công thức này là bước đầu tiên để giải quyết các bài toán hóa học phức tạp hơn.
Công Thức Tính Số Mol
Số mol (n) của một chất được tính bằng khối lượng của chất đó (m) chia cho khối lượng mol của chất đó (M). Công thức: n = m/M. Ví dụ, nếu bạn có 18g nước, số mol nước sẽ là: n = 18g / 18 g/mol = 1 mol. Công thức này thường được sử dụng kết hợp với các công thức khác để tính toán lượng chất tham gia và tạo thành trong phản ứng hóa học. Bạn có thể tìm hiểu thêm về tính phần trăm thể tích tại đây.
Công Thức Tính Nồng Độ Phần Trăm
Nồng độ phần trăm (C%) của một chất trong dung dịch được tính bằng khối lượng chất tan (mct) chia cho khối lượng dung dịch (mdd) nhân 100%. Công thức: C% = (mct/mdd) 100%. Ví dụ, nếu bạn hòa tan 10g muối ăn vào 90g nước, nồng độ phần trăm của muối ăn trong dung dịch sẽ là: C% = (10g / 100g) 100% = 10%.
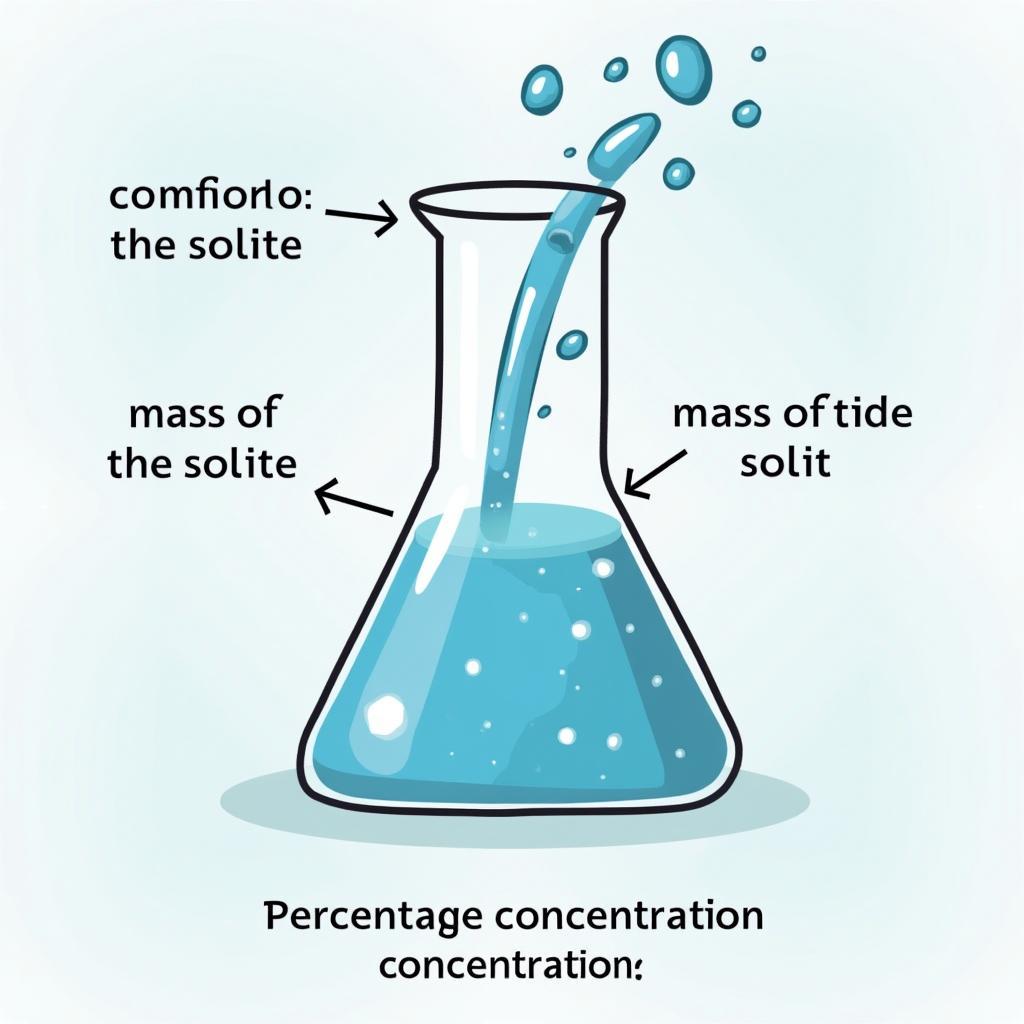 Công thức tính nồng độ phần trăm
Công thức tính nồng độ phần trăm
Công Thức Tính Nồng Độ Mol
Nồng độ mol (CM) của một chất trong dung dịch được tính bằng số mol chất tan (n) chia cho thể tích dung dịch (V) tính bằng lít. Công thức: CM = n/V. Ví dụ, nếu bạn hòa tan 0.5 mol đường vào 1 lít nước, nồng độ mol của đường trong dung dịch sẽ là: CM = 0.5 mol / 1 lít = 0.5 M. Tính toán nồng độ mol rất quan trọng trong các thí nghiệm hóa học.
Các Công Thức Hóa Học 8 Quan Trọng Khác
Ngoài các công thức trên, còn một số công thức hóa học 8 quan trọng khác mà bạn cần nắm vững như công thức tính thể tích chất khí, công thức tính hiệu suất phản ứng, và các công thức liên quan đến định luật bảo toàn khối lượng. Công thức tính độ mặn của nước biển cũng là một ví dụ thú vị về ứng dụng của hóa học trong đời sống.
GS. TS. Nguyễn Văn A, chuyên gia hóa học hàng đầu Việt Nam, chia sẻ: “Việc nắm vững các công thức hóa học 8 là nền tảng vững chắc cho việc học tập hóa học ở các cấp học cao hơn.”
Kết luận
Các công thức hóa học 8 là kiến thức cơ bản và quan trọng trong chương trình học. Hy vọng bài viết này đã cung cấp cho bạn một cái nhìn tổng quan và chi tiết về các công thức này. Hãy luyện tập thường xuyên để nắm vững và áp dụng chúng một cách hiệu quả. Các công thức hóa học 8 là chìa khóa để bạn khám phá thế giới hóa học đầy thú vị.
FAQ
- Làm thế nào để nhớ các công thức hóa học 8 dễ dàng hơn?
- Tại sao việc học các công thức hóa học 8 lại quan trọng?
- Tôi có thể tìm tài liệu tham khảo về các công thức hóa học 8 ở đâu?
- Làm thế nào để áp dụng các công thức hóa học 8 vào bài tập?
- Có những mẹo nào để tính toán nhanh chóng với các công thức hóa học 8?
- Ứng dụng của các công thức hóa học 8 trong đời sống là gì?
- Tôi nên làm gì nếu gặp khó khăn trong việc hiểu và áp dụng các công thức hóa học 8?
Bạn có thể tìm hiểu thêm về tủ đông 1000 lít hoặc các chất không tác dụng với hno3 đặc nóng trên trang web của chúng tôi. Tham khảo thêm thông tin về ph 28 để hiểu rõ hơn về độ pH.
Khi cần hỗ trợ hãy liên hệ Email: [email protected], địa chỉ: Đường Nguyễn Văn Linh, Quận Hải Châu, Đà Nẵng, Việt Nam. Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.
